
| 化学键 | Si-Si | O=O | Si-O |
| 键能/kJ•mol-1 | a | b | c |


分析 I.根据反应热=反应物总键能-生成物总键能计算可得Si+O2$\frac{\underline{\;高温\;}}{\;}$SiO2的热化学方程式;
Ⅱ.(1)由图可知,电解池A中,电解HI生成氢气与I2,电解池B中为电解铁盐溶液,生成Fe2+、O2、H+;
(2)根据同一电路中,电子转移守恒计算;
Ⅲ.(1)①在恒温恒压下,要使平衡状态与原平衡状态完全等效,可以采用极限转化处理,按化学计量数转化到左边,应满足2体积N2、6体积H2,计算原平衡时氨气的体积,根据氨气体积判断反应进行方向;
②若让反应逆向进行,氨气的体积必须大于原平衡时氨气的体积,最大值则为2体积氮气和6体积氢气完全反应时产生的氨气的体积;
(2)平衡后混合气体为6.5体,说明反应正向移动,恒压条件下,应是改变温度影响平衡移动,根据温度对化学平衡移动的影响知识来回答.
解答 解:Ⅰ.硅高温燃烧的方程式为Si+O2$\frac{\underline{\;高温\;}}{\;}$SiO2,1molSi中含有2molSi-Si键,1molSiO2中含有4molSi-O键,故该反应的反应热=2×akJ/mol+bkJ/mol-4×ckJ/mol=(2a+b-4c)kJ/mol,故该反应热化学方程式为:Si(s)+O2(g)=SiO2(s)△H=(2a+b-4c)kJ/mol,
故答案为:Si(s)+O2(g)=SiO2(s)△H=(2a+b-4c)kJ/mol;
Ⅱ.(1)由图可知,电解池A中,电解HI生成氢气与I2,电解池中总反应的离子方程式为:2H++2I-=H2↑+I2 ;电解池B中为电解铁盐溶液,生成Fe2+、O2、H+,电解池中总反应的离子方程式为:4Fe3++2H2O=4Fe2++O2↑+4H+;
故答案为:2H++2I-=H2+I2;4Fe3++2H2O=4Fe2++O2+4H+;
(2)电解池A中生成3.36L H2(标准状况),氢气的物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,根据电子转移守恒,有H2~2e-~2Fe2+,则生成Fe2+的物质的量为0.15mol×2=0.3mol;
故答案为:0.3;
Ⅲ.(1)①反应达到平衡后混合气体中各物质的量仍与上述平衡时完全相同,恒温恒压条件下,采用极限分析,按化学计量数转化到左边,相同物质的投入量应相同,2体积的氨气完全转化得到1体积氮气、3体积氢气,则氮气为1+a=1,氨气为3+b=6,应满足a=1,则a+1=2,b+3=6,则b=3;
因反应前原混合气体为8体积,反应后混合气体为7体积,体积差为1体积,则:
N2(g)+3H2(g)?2NH3(g) 体积减少
2 2
1 1
故平衡时氨气为1体积,而在起始时,氨气的体积c=2体积,比平衡状态时大,为达到同一平衡状态,氨的体积必须减小,所以平衡逆向移动;
故答案为:3;逆;
②若让反应逆向进行,由上述①所求出的平衡时氨气为1体积,氨气的体积必须大于1体积,最大值则为2体积氮气和6体积氢气完全反应时产生的氨气的体积,即为4体积,则1<c≤4;
故答案为:1<c≤4;
(2)控制平衡后混合气体为6.5体积,气体的总分子数减少,则要求平衡正向移动,该反应为放热反应,恒压条件下,只能为降低温度;
故答案为:降低温度;降低温度平衡向正反应方向移动,气体总分子数减少.
点评 本题涉及热化学方程式书写、电解原理、等效平衡、化学平衡影响因素等,Ⅰ为易错点,要求学生掌握硅及二氧化硅的晶体结构确定1mol物质含有化学键是关键,Ⅲ中注意理解等效平衡原理,注意各物质的量与原平衡相等,按化学计量数转化到左边满足对应物质等量,不能是等比,本题综合性强,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗将酒精和水分离 | |
| B. | 用焰色反应鉴别Na2SO4和Na2CO3 | |
| C. | 用NaOH 溶液除去Cl2中混有的少量HCl | |
| D. | 用灼烧并闻气味,确定纤维是否是蛋白质纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H4=$\frac{2}{3}$ (3△H3-△H1)-△H2 | B. | △H4=$\frac{2}{3}$ (△H1+△H2)+△H3 | ||
| C. | △H4=$\frac{2}{3}$ (△H1+△H2)-△H3 | D. | △H4=$\frac{2}{3}$ (△H1-△H2)-△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.50 | 2.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
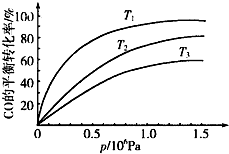 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
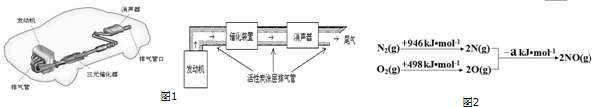
| m | α | y |
| 1 | 0.25 | 16.67% |
| 2 | 0.45 | |
| 3 | 0.56 | 19.35% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,平衡常数K变大 | |
| B. | 增大压强,W(g)物质的量分数变大 | |
| C. | 升温,若混合气体的平均相对分子质量变小,则正反应放热 | |
| D. | 增大X浓度,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaCl | Na2CO3 | NaClO | NaHCO3 |
| pH | 7 | 11.6 | 9.7 | 8.3 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力:HCl>H2CO3>HClO | |
| B. | 等体积等物质的量浓度的NaCl溶液与NaClO溶液中Cl-和ClO-离子个数:Cl->ClO- | |
| C. | 向Na2CO3溶液中逐滴滴入少量稀盐酸,反应为:Na2CO3+2HCl=2NaCl+CO2↑+H2O | |
| D. | 若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中:2c(CO32-)+c(HCO3-)=0.2mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com