
| A. | 用分液漏斗将酒精和水分离 | |
| B. | 用焰色反应鉴别Na2SO4和Na2CO3 | |
| C. | 用NaOH 溶液除去Cl2中混有的少量HCl | |
| D. | 用灼烧并闻气味,确定纤维是否是蛋白质纤维 |
分析 A.互溶的液体应该采用蒸馏方法,不互溶的液体采用分液方法分离;
B.钠元素焰色反应呈黄色;
C.氯气和HCl都能和NaOH反应,但HCl易溶于水,氯化钠溶液抑制氯气溶解;
D.蛋白质燃烧具有烧焦羽毛的气味.
解答 解:A.互溶的液体应该采用蒸馏方法,不互溶的液体采用分液方法分离,乙醇和水互溶,应该采用蒸馏方法分离,故A错误;
B.钠元素焰色反应呈黄色,碳酸钠、硫酸钠的焰色反应都呈黄色,不能用焰色反应鉴别,二者阴离子不同,可以用稀盐酸鉴别,稀盐酸和碳酸钠反应生成气体,和硫酸钠不反应,故B错误;
C.氯气和HCl都能和NaOH反应,但HCl易溶于水,氯化钠溶液抑制氯气溶解,所以应该用饱和食盐水除去氯气中的HCl,故C错误;
D.蛋白质燃烧具有烧焦羽毛的气味,所以可以用灼烧的方法鉴别蛋白质纤维,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及物质鉴别、除杂、物质分离提纯,明确元素化合物性质差异性、物质分离提纯方法是解本题关键,利用物质性质差异性鉴别、分离提纯.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、K+、ClO- 都可在该物质的溶液中大量共存 | |
| B. | 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色 | |
| C. | 向0.1mol•L-1该物质的溶液中逐滴滴加0.1mol•L-1NaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如上图所示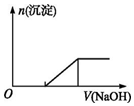 | |
| D. | 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-═2BaSO4↓+Fe(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | Si-Si | O=O | Si-O |
| 键能/kJ•mol-1 | a | b | c |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com