
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 64.0 | 50.7 | 42.9 |
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
分析 I、K为生成物浓度幂之积与反应物浓度幂之积的比,纯固体不能代入K的表达式中,由表格数据可知,温度越高,K越小,则升高温度平衡逆向移动;
Ⅱ、在相同温度下发生反应,则①②中K相同,由①中放热为32.8kJ,可知参加反应的CO为$\frac{32.8kJ}{41kJ/mol}$=0.8mol,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 1 4 0 0
转化 0.8 0.8 0.8 0.8
平衡 0.2 3.2 0.8 0.8
结合转化率=$\frac{转化的量}{开始的量}$×100%、平衡浓度计算K来解答.
解答 解:I、Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)中 K=$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$,由表格数据可知,温度越高,K越小,则升高温度平衡逆向移动,正反应为放热反应,△H<0,
故答案为:$\frac{{c}^{3}(C{O}_{2})}{{c}^{3}(CO)}$;<;
II、在相同温度下发生反应,则①②中K相同,由①中放热为32.8kJ,可知参加反应的CO为$\frac{32.8kJ}{41kJ/mol}$=0.8mol,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 1 4 0 0
转化 0.8 0.8 0.8 0.8
平衡 0.2 3.2 0.8 0.8
(1)容器①中反应达平衡时,CO的转化率为$\frac{0.8mol}{1mol}$×100%=80%,故答案为:80%;
(2)K=$\frac{\frac{0.8}{V}×\frac{0.8}{V}}{\frac{0.2}{V}×\frac{3.2}{V}}$=1,故答案为:1.
点评 本题考查化学平衡的计算,为高频考点,把握平衡三段法、K的表达式及计算、平衡移动为解答的关键,侧重分析与应用能力的考查,注意II中温度相同,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 此反应在任何温度下都能自发进行 | |
| B. | 此反应仅在低温下自发进行 | |
| C. | 此反应仅在高温下自发进行 | |
| D. | 此反应在任何温度下都不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗将酒精和水分离 | |
| B. | 用焰色反应鉴别Na2SO4和Na2CO3 | |
| C. | 用NaOH 溶液除去Cl2中混有的少量HCl | |
| D. | 用灼烧并闻气味,确定纤维是否是蛋白质纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
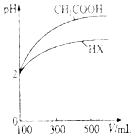 水是生命的源泉,工业的血液、城市的命脉,要保护好河流,河水是重要的饮用水源,污染物通过用水直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请问答下列问题:
水是生命的源泉,工业的血液、城市的命脉,要保护好河流,河水是重要的饮用水源,污染物通过用水直接毒害人体,也可通过食物链和灌溉农田间接危及健康.请问答下列问题:| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3x10-7,K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
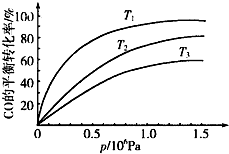 铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.回答下列问题:| 温度 | 250℃ | 600℃ | 1000℃ | 2000℃ |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.214 | 0.202 | 0.193 | 0.193 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com