
����Ŀ�����������£����淴Ӧ��2NO(g)+O2(g) ![]() 2NO2(g)������̶����ܱ������н��У��ﵽƽ��״̬�ı�־����
2NO2(g)������̶����ܱ������н��У��ﵽƽ��״̬�ı�־����
��NO������������ٸı��״̬ �ڵ�λʱ��������n mol O2��ͬʱ����2n mol NO
�ۻ���������ɫ���ٸı��״̬ �����������ܶȲ��ٸı��״̬
�ݻ�������ƽ����Է����������ٸı��״̬
A. �٢ۢ� B. �ڢۢ� C. �٢ܢ� D. ȫ��
���𰸡�A
����������NO������������ٸı䣬˵�����淴Ӧ������ȣ���Ӧ�ﵽ��ƽ�⣬����ȷ���ڵ�λʱ��������nmolO2��ͬʱ�ض�����2nmolNO������֤�����淴Ӧ������ȣ����Ը÷�Ӧ��һ���ﵽƽ��״̬���ʴ��ۻ���������ɫ���ٸı���˵�������������ʵ���Ũ�Ȳ��䣬��Ӧ�ﵽƽ��״̬������ȷ���ܷ�Ӧǰ�������������䡢����������䣬���Ի��������ܶ�ʼ�ղ��䣬���Բ��ܾݴ��ж�ƽ��״̬���ʴ��ݸ÷�Ӧ��һ����Ӧǰ���������ʵ�����С�Ŀ��淴Ӧ������������ƽ����Է����������ٸı䣬˵������ֵ����ʵ������䣬��Ӧ�ﵽƽ��״̬������ȷ����ѡA��


 ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� 1��18 ��Ԫ�ؼ����γɵĻ�����Ļ�ѧʽ��գ�
��1��ԭ�Ӱ뾶��С��Ԫ����_____��
��2����ϡ�������⣬ԭ�Ӱ뾶����Ԫ����_____������ԭ�ӽṹʾ��ͼ ��_____��
��3����ˮ��Ӧ����ҵĽ�����_____��
��4������������ˮ���������ǿ����_____��
��5������������ˮ����Ϊ���������������_____��
��6����̬�⻯���ˮ��Һ�ʼ��Ե�Ԫ����_____��
��7�����ȶ�����̬�⻯����_____��
��8����������ǿ��Ԫ����_____���ǽ�������ǿ��Ԫ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����þ������þ��������ɰ����(Na2B4O7��10H2O)ʱ�ķ���������Ҫ�ɷ���MgO��������Na2B4O7��CaO��Fe2O3��FeO��MnO��SiO2�����ʡ�����þ��Ϊԭ����ȡ��ˮ����þ�Ĺ����������£�

�ش��������⣺
(l)Na2B4O7��10H2O��B�Ļ��ϼ�Ϊ__________��
(2)Na2B4O7������ˮ��Ҳ����ˮ�⣺B4O72-+7H2O![]() 4H3BO3(����)+2OH-(�����ڳ������ܽ�Ƚ�С)��д����������ʱNa2B4O7������Ӧ�Ļ�ѧ����ʽ��______________��
4H3BO3(����)+2OH-(�����ڳ������ܽ�Ƚ�С)��д����������ʱNa2B4O7������Ӧ�Ļ�ѧ����ʽ��______________��
(3)����B�к��в�����ϡ���ᵫ��������Ũ����ĺ�ɫ���壬д�����ɺ�ɫ��������ӷ���ʽ____________��
(4)����MgO��Ŀ����___________________��
(5)��֪MgSO4��CaSO4���ܽ�����±���
�¶�(��) �ܽ��(g) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
������A���ǽ�MgSO4��CaSO4�����Һ�е�CaSO4��ȥ�������ϱ����ݣ���Ҫ˵��������A������Ϊ____________________��
(6)��ɰҲ���ڹ�ҵ����ȡNaBH4��NaBH4����Ϊ�л���ѧ�еġ����ܻ�ԭ������
��д��NaBH4�ĵ���ʽ��___________��
�ڡ���Ч�⺬�����������������ԭ���Ļ�ԭ�������䶨���ǣ�ÿ�˺��ԭ���Ļ�ԭ�����൱�ڶ��ٿ�H2�Ļ�ԭ������NaBH4����Ч�⺬��Ϊ_________��������λС������
���ڼ��������£��������ϵ��NaBO2Ҳ���Ƶ����⻯�ƣ�д�������ҵĵ缫��Ӧʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ϊ10 mL�����ʵ���Ũ����ͬ������NaOH ��Һ�зֱ�ͨ��һ������CO2���õ���Һ���ҡ���ס�������Һ�зֱ�μ�0.1mol/L����������ʱ��Ӧ����CO2���(��״��)��������������Ĺ�ϵ��ͼ��ʾ�������������в���ȷ����

A. ԭNaOH��Һ�����ʵ���Ũ��Ϊ0.5 mol/L
B. ��0����)<10 mLʱ������Һ�з�����Ӧ�����ӷ���ʽΪH++CO32-=HCO3-
C. ����Һ�к��е�������Na2CO3��NaOH
D. ������Һ�еμӹ�����������CO2��������ֵΪ224 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ�����·�Ӧ���ɻ�ȡO2�������й�˵������ȷ����
�ٹ���ֽ�ˮ��������2H2O(l)��2H2(g) + O2(g) ��H1��+571.6 kJ��mol��1
�ڹ�������ֽ���������2H2O2(l)��2H2O(l) + O2(g) ��H2����196.4 kJ��mol��1
��һ�������ֽ���������2NO(g)��N2(g) + O2(g) ��H3����180.5 kJ��mol��1
A. ��Ӧ�������ǻ�ȡH2��;��֮һ
B. ��Ӧ�����۶��ǻ�ѧ��ת��Ϊ����
C. ��ӦH2O2(l)��H2O(g)+ ![]() O2(g)����H����98.2 kJ��mol��1
O2(g)����H����98.2 kJ��mol��1
D. ��Ӧ2H2(g)+2NO(g)��N2(g)+2H2O(l)����H����752.1 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ�ֿɳ�������ӵ�س�ŵ�Ĺ���ʾ��ͼ���ŵ�ʱ�õ�صĵ缫��ӦʽΪ��
������LixC6��xe����C6��xLi����LixC6��ʾ�ԭ��Ƕ��ʯī�γɵĸ��ϲ�����
������Li1��xMnO2��xLi����xe����LiMnO2��LiMnO2��ʾ���ԭ�ӵĶ���������
�����й�˵������ȷ����

A. �õ�صķ�ӦʽΪLi1��xMnO2��LixC6��LiMnO2��C6
B. K��M���ʱ��A������������������Ӧ
C. K��N���ʱ��Li����A����Ǩ�Ƶ�B����
D. �������䡢�ŵ���������ٴ���3����ʽ������ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. 1mol�������������22.4L
B. ͬ��ͬѹ���������壬ֻҪ���ǵķ�������ͬ����ռ���Ҳһ����ͬ
C. �ڱ�״���£����Ϊ22.4L�����ʶ���1mol
D. �ڷDZ�״���£�1mol�κ�����������������22.4L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������m gij���壬����˫ԭ�ӷ��ӹ��ɣ�����Ħ������ΪM g��mol��1���������ӵ�������NA��ʾ����
(1)����������ʵ���Ϊ________mol��
(2)����������ԭ������Ϊ________����
(3)�������ڱ�״���µ����Ϊ_______L��
(4)�������ڱ�״���µ��ܶ�Ϊ____g��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ե��Ӳ�Ʒ����ж��ص����ԡ���չ�Ե��ŵ�����Ϣ��ҽ�ơ���Դ��������й㷺Ӧ��ǰ������ͼΪ�п�Ժ���²����������й���ͳ�鷨����������ֱ�ӽ���ë����д���ֽ�ź�﮲���Ϊ�缫������װ�ɵ�﮿������������˵������ȷ���ǣ�������
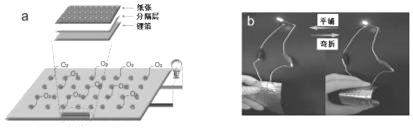
A. ֽ�ŵ缫�Ǹõ�ص�����
B. ﮲��缫�����ĵ缫��Ӧ��Li��e����Li+
C. ��ع���ʱ�����Ӵ�﮲��缫����������ֽ�ŵ缫���ٴ�ֽ�ŵ缫���������Һ����﮲��缫
D. �õ�ؾ������͡������ҿ��۵����ص㣬����Ӧ�������Ե�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com