
【题目】用 1~18 号元素及其形成的化合物的化学式填空.
(1)原子半径最小的元素是_____.
(2)除稀有气体外,原子半径最大的元素是_____,它的原子结构示意图 是_____.
(3)与水反应最剧烈的金属是_____.
(4)最高价氧化物的水化物碱性最强的是_____.
(5)最高价氧化物的水化物为两性氢氧化物的是_____.
(6)气态氢化物的水溶液呈碱性的元素是_____.
(7)最稳定的气态氢化物是_____.
(8)金属性最强的元素是_____,非金属性最强的元素是_____.
【答案】HNa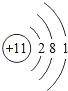 NaNaOHAl(OH)3NH3HFNaF
NaNaOHAl(OH)3NH3HFNaF
【解析】
(1)原子的电子层数越少,其原子半径越小,同一周期元素中,原子半径随着原子序数增大而减小;(2)原子的电子层数越少,其原子半径越小,同一周期元素中,原子半径随着原子序数增大而减小;(3)金属性最强的元素是Na元素;(4)元素的金属性越强,其最高价氧化物的水化物碱性越强;(5)最高价氧化物的水化物为两性氢氧化物的是氢氧化铝;(6)气态氢化物的水溶液呈碱性的气体是NH3;(7)非金属性越强,气态氢化物越稳定;(8)同周期,从左到右,金属性减弱,同主族,从上到下,非金属性减弱。
(1)原子的电子层数越少,其原子半径越小,同一周期元素中,原子半径随着原子序数增大而减小,原子半径最小的是H元素,故答案为:H;(2)原子的电子层数越少,其原子半径越小,同一周期元素中,原子半径随着 原子序数增大而减小,最大的是Na元素,钠原子结构示意图为 ,故答案为:Na;
,故答案为:Na; ;(3)金属性最强的元素是 Na 元素,金属性越强,性质越活泼,与水反应越剧 烈,故答案为:Na;(4)Na的金属性最强,则NaOH 的碱性最强,故答案为:NaOH;(5)最高价氧化物的水化物为两性氢氧化物的是氢氧化铝;故答案为:Al(OH)3;(6)气态氢化物的水溶液呈碱性的气体是NH3;故答案为:NH3;(7)非金属性越强,气态氢化物越稳定,F 元素的非金属性最强,故氟化氢最 稳定,故答案为:HF;(8)同周期,从左到右,金属性减弱,同主族,从上到下,非金属性减弱,故 金属性最强的为钠,非金属性最强的元素是氟元素,故答案为:Na;F。
;(3)金属性最强的元素是 Na 元素,金属性越强,性质越活泼,与水反应越剧 烈,故答案为:Na;(4)Na的金属性最强,则NaOH 的碱性最强,故答案为:NaOH;(5)最高价氧化物的水化物为两性氢氧化物的是氢氧化铝;故答案为:Al(OH)3;(6)气态氢化物的水溶液呈碱性的气体是NH3;故答案为:NH3;(7)非金属性越强,气态氢化物越稳定,F 元素的非金属性最强,故氟化氢最 稳定,故答案为:HF;(8)同周期,从左到右,金属性减弱,同主族,从上到下,非金属性减弱,故 金属性最强的为钠,非金属性最强的元素是氟元素,故答案为:Na;F。


科目:高中化学 来源: 题型:
【题目】有机物G是一种常用的植物调味油,可按如下路线合成:
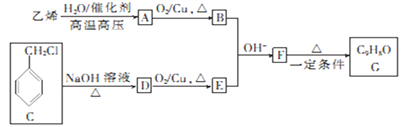
已知:![]()
回答下列问题:
(1)下列关于乙烯的说法不正确的是_________(填字母)。
a.分子中所有原子共平面
b.能发生氧化反应,不能发生还原反应
c.能发生加聚反应生成高分子
d.能使酸性高锰酸钾溶液褪色
(2)由F生成G的反应类型为_________________________。
(3)C中官能团的名称为___________,由C生成D的反应类型为___________。
(4)D的化学名称为___________,由D生成E的化学方程式为___________。
(5)苯环上含有两个取代基,且分子中含有酯基的F的同分异构体有_________种,其中核磁共振氢谱显示有四组峰,且峰面积之比为3:2:2:3的是__________(填结构简式)。
(6)参照上述合成路线,设计以B为原料(无极试剂任选)制备高吸水性树脂![]() 的合成路线:________________。
的合成路线:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 稀硝酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B. 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-=NH3↑+H2O
C. 往酸性碘化钾溶液中滴加适量的双氧水:2I-+2H++H2O2=I2+2H2O
D. HS-的电离:HS-+H2O![]() OH-+HS-
OH-+HS-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的一半。下列说法正确的是()
A. 原子半径:W>Z>Y>X>M
B. 将XZ2通入W单质与水反应后的溶液中,一定只生成碳酸钠
C. 由X、Y、Z、M四种元素形成的化合物中一定有共价键可能有离子键
D. CaX2、CaM2、CaZ2等3种化合物中,阳离子和阴离子个数比均为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到红色金属M和金属E并进行如下框图所示转化,获得高效净水剂K2EO4。
(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):
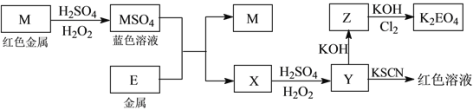
(1)写出M溶于稀H2SO4和H2O2混合液的离子方程式:_______________________________。
(2)检验X中阳离子的方法和现象是__________________________________________________。
(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色。写出与上述变化过程相关的离子方程式:_______________________________、____________________________________。
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、蒸发皿、铁架台外,还需要用到的玻璃仪器有________、________、 __________(填写仪器名称)。
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图,A中试剂是盐酸。
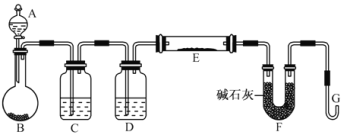
①仪器B中应装入___________,装置D的作用_________________________;
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体” ?
___________________________在这两步之间还应进行的操作是_________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1![]()
![]() 溶液与0.1
溶液与0.1![]()
![]() 溶液等体积混合,所得溶液中:
溶液等体积混合,所得溶液中:![]()
B. 20![]() 0.1
0.1![]()
![]() 溶液与10
溶液与10![]() 0.1
0.1![]()
![]() 溶液混合后溶液呈酸性,所得溶液中:
溶液混合后溶液呈酸性,所得溶液中:![]()
C. 室温下,![]() 的盐酸与
的盐酸与![]() 的氨水等体积混合,所得溶液中:
的氨水等体积混合,所得溶液中:![]()
D. 0.1![]()
![]() 溶液与0.1
溶液与0.1![]()
![]() 溶液等体积混合,所得溶液中:
溶液等体积混合,所得溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g) ![]() 2Z(g),此反应达到平衡状态的标志是( )
2Z(g),此反应达到平衡状态的标志是( )
A. 容器内气体密度不随时间变化 B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2 D. 单位时间内消耗0.1 mol X,同时生成0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g) ![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是
①NO的体积分数不再改变的状态 ②单位时间内生成n mol O2的同时生成2n mol NO
③混合气体的颜色不再改变的状态 ④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A. ①③⑤ B. ②③⑤ C. ①④⑤ D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com