
【题目】某同学在实验室进行1,2-二溴乙烷的消去反应,按下列步骤进行,请填空:

(1)按图连接好仪器装置并___。
(2)在试管a中加入2 mL 1,2-二溴乙烷和5 mL 10% NaOH的___溶液,再向试管中加入几片___。
(3)在试管b中加少量溴水。
(4)用水浴法加热试管里的混合物,持续加热一段时间后,把生成的气体通入溴水中,观察到的现象是____。
(5)①写出发生反应的化学方程式:__________。
②本实验中应注意的问题有______。
【答案】检查装置的气密性 乙醇 碎瓷片 溴水褪色 CH2BrCH2Br+2NaOH![]() CH≡CH↑+2NaBr+2H2O;CH≡CH+Br2 CH≡CH+Br2BrCH=CHBr(或 CH≡CH+2Br2 Br2CH—CHBr2) 为防止暴沸,在试管中应加入碎瓷片;用水浴加热,注意不要使水沸腾
CH≡CH↑+2NaBr+2H2O;CH≡CH+Br2 CH≡CH+Br2BrCH=CHBr(或 CH≡CH+2Br2 Br2CH—CHBr2) 为防止暴沸,在试管中应加入碎瓷片;用水浴加热,注意不要使水沸腾
【解析】
卤代烃的消去反应是卤代烃和氢氧化钠醇溶液共热条件下进行的,分子内消去卤化氢(发生β-H消去),引入碳碳双键等不饱和键,故1,2-二溴乙烷的消去反应,可能得到溴乙烯或乙炔,据此回答;
(1)为了使反应顺利进行,连接仪器组装成一套装置后、在实验前要检验装置气密性;故答案为:检查装置的气密性;
(2)1,2二溴乙烷发生消去反应需要在氢氧化钠的醇溶液中并加热,故在试管a中加入2m L 1,2一二溴乙烷和5 mL10%NaOH溶液,再向试管中加入乙醇,为防止暴沸要加入碎瓷片;
故答案为:乙醇;碎瓷片;
(4)该实验采用水浴加热,其优点是温度不高且易受热均匀,所以用水浴加热试管的混合物;1,2二溴乙烷和NaOH的醇溶液发生消去反应可生成溴乙烯或乙炔,它们均能和溴发生加成反应而使溴水褪色,所以观察到的现象是溴水褪色;
故答案为:水浴;溴水褪色;
①在加热条件下,1,2二溴乙烷和氢氧化钠的醇溶液发生消去反应生成乙炔、NaBr和水,乙炔和溴发生加成反应,反应方程式为CH2BrCH2Br+2NaOH![]() CH≡CH↑+2NaBr+2H2O; CH≡CH+Br2 CH≡CH+Br2BrCH=CHBr(或 CH≡CH+2Br2Br2CH—CHBr2);
CH≡CH↑+2NaBr+2H2O; CH≡CH+Br2 CH≡CH+Br2BrCH=CHBr(或 CH≡CH+2Br2Br2CH—CHBr2);
故答案为:CH2BrCH2Br+2NaOH![]() CH≡CH↑+2NaBr+2H2O;CH≡CH+Br2 CH≡CH+Br2BrCH=CHBr(或 CH≡CH+2Br2Br2CH—CHBr2);
CH≡CH↑+2NaBr+2H2O;CH≡CH+Br2 CH≡CH+Br2BrCH=CHBr(或 CH≡CH+2Br2Br2CH—CHBr2);
②为防止安全事故发生,该实验要防止暴沸,在试管中应该加入碎瓷片;用水浴加热注意不能使水沸腾;
故答案为:为防止暴沸,在试管中应加入碎瓷片;用水浴加热,注意不要使水沸腾。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列操作对应的现象和离子方程式均正确的是( )
操作 | 现象 | 离子方程式 | |
A | 饱和碳酸钠溶液中通入过量CO2 | 无明显变化 | CO |
B | 向苏打溶液溶液中滴加稀硫酸 | 立即产生气泡 | CO |
C | 向Ba(OH)2溶液中加足量NaHCO3溶液 | 生成白色沉淀 | 2HCO |
D | 向NaHCO3溶液中加入少量偏铝酸钠 | 生成白色沉淀和无色气体 | HCO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图(Ea表示活化能)是CH4与Cl2生成CH3Cl的部分反应过程中各物质物质的能量变化关系图,下列说法正确的是( )
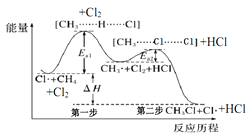
A.Cl·可由Cl2在高温条件下生成,是CH4与Cl2反应的催化剂
B.升高温度,Ea1、Ea2均减小,反应速率加快
C.增大Cl2的浓度,可提高反应速率,但不影响△H的大小
D.第一步反应的速率大于第二步反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是( )
选项 | 操作及现象 | 结论 |
A | 加入AgNO3溶液,生成白色沉淀,再加稀盐酸沉淀不溶解 | 原溶液中有Cl-存在 |
B | 通入Cl2后,溶液变为深黄色,继续加入淀粉溶液后溶液变蓝 | 原溶液中有I-存在 |
C | 加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸后沉淀不溶解时 | 原溶液中有 |
D | 加入稀盐酸,生成的气体能使澄清石灰水变浑浊 | 原溶液中有 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某溶液X可能由K+、Mg2+、Cu2+、Ag+、Ba2+、Al3+、Fe2+、![]() 、
、![]() 、
、![]() 、I-、
、I-、![]() 、
、![]() 中的若干种离子组成。某化学兴趣小组通过下列实验确定了其组成。
中的若干种离子组成。某化学兴趣小组通过下列实验确定了其组成。
(1)根据下列实验步骤和现象,推断实验结论:
实验步骤与实验现象 | 实验结论 |
Ⅰ.观察溶液:无色透明 | ①原溶液中一定不含的离子是____。 |
Ⅱ.取适量该溶液,加入过量的硝酸,有气体生成,并得到无色溶液 | ②原溶液中一定不含的离子是_____,一定含有的离子是____。 |
Ⅲ.在Ⅱ所得溶液中再加入过量的碳酸氢铵溶液,有气体生成,同时析出白色沉淀A | ③原溶液中还一定含有的离子是____,生成沉淀A的离子方程式为____。 |
Ⅳ.在Ⅲ所得溶液中再逐滴加入氢氧化钡溶液至过量,加热也有气体生成,同时析出白色沉淀B | ④白色沉淀B中一定含有___,可能含有____。 |
(2)上述实验步骤Ⅳ中开始阶段一定发生的离子方程式是______。
(3)该化学兴趣小组的同学为了进一步确定B的成分,取一定量经洗涤后的B与Y溶液反应,白色固体的物质的量与Y溶液体积之间的关系如图所示。
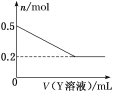
Y可能为(填化学式)____,B的组成为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,甲是利用微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中错误的是( )
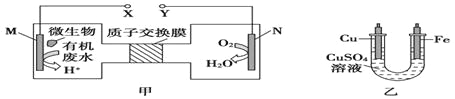
A.乙装置中溶液颜色不变
B.铜电极应与Y相连接
C.M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
D.当N电极消耗0.25mol气体时,铜电极质量减少16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐(3PbO·PbSO4·H2O,相对分子质量为990)可用作聚氯乙烯的热稳定剂,不溶于水。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示:
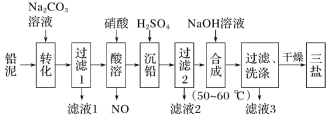
已知:Ksp(PbSO4)=1.82×10-8;Ksp(PbCO3)=1.46×10-13。回答下列问题:
(1)加Na2CO3溶液转化的目的是__。
(2)酸溶时,不直接使用H2SO4溶液的原因可能是__;铅与硝酸在酸溶过程中发生反应的离子方程式为__。
(3)流程中可循环利用的物质是__;洗涤操作时,检验沉淀是否洗涤干净需要的试剂是__。
(4)当沉淀转化达平衡时,滤液l中c(![]() )与c(
)与c(![]() )的比值为__。
)的比值为__。
(5)50~60℃时合成三盐的化学方程式为__;若得到纯净干燥的三盐99.0t,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了检验和除去下表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内。
物质 | 检验试剂 | 除杂试剂 |
(Ⅰ)甲烷(乙烯) | ________。 | ________。 |
(Ⅱ)酒精(水) | ________。 | ________。 |
①检验试剂:
A.无水硫酸铜 B.酸性高锰酸钾溶液
C.水 D.氢氧化钠溶液
②除杂试剂:
a.无水硫酸铜 b.乙酸
c.新制的生石灰 d.溴水
除杂时,乙烯发生反应的化学方程式为____________________。
(2)如图,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
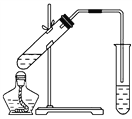
试回答:
在右试管中通常加入________溶液,实验生成的乙酸乙酯,其密度比水________,是有特殊香味的液体。分离右试管中所得乙酸乙酯的操作为(只填名称)________。反应中加入浓硫酸的作用是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工原料。
Ⅰ、某学习小组同学设计了下图所示的实验装置(部分夹持仪器未画出),进行氨气实验室制备且探究氨气的还原性及产物的检验。
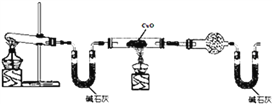
实验现象为:黑色CuO变为红色;干燥管中无水CuSO4粉末变为蓝色;同时生成一种无色无味无污染的气体。
(1)请写出大试管中反应的化学方程式_______________________________________。
(2)请写出氨气与CuO反应的化学方程式_________________________________________。
(3)该装置存在明显缺陷,请指出存在的问题______________________。
Ⅱ、哈伯因为将氮气和氢气在一定条件下合成氨气的成果面获得1918年诺贝尔化学奖。现将1molN2和3molH2充入一恒容的密闭容器中,使其在一定条件下达到平衡N2+3H2![]() 2NH3,下列哪些状态一定是达到平衡的状态?(_____)
2NH3,下列哪些状态一定是达到平衡的状态?(_____)
A.混合气体的平均相对分子质量不随时间改变而改变的状态
B.N2、H2、NH3的总物质的量不随时间改变而改变的状态
C.混合气体的密度不随时间改变而改变的状态
D.单位时间内0.1molNH3分解的同时,有0.05molN2生成的状态
Ⅲ、下图是一种电化学制备NH3的装置,图中陶瓷在高温时可以传输H+。
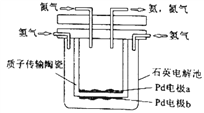
(1)H+经质子传输陶瓷由_____________流向_______________。(选填“a”或“b”)
(2)阴极发生的电极反应为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com