
【题目】X、Y、Z、W代表短周期的四种元素,有关它们的部分信息如下表所示:
元素 | 部分结构特点 | 部分性质 |
X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2等 |
Y | Y原子的次外层电子数等于最外层电子数的一半 | Y元素能形成多种单质 |
Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价的代数和等于6 |
W | 第三周期元素的简单离子中半径最小 | W的单质化学性质虽较活泼,但只需常温保存 |
请按要求回答下列问题(注意不能用字母X、Y、Z、W作答,请用相应的元素符号或化学式填写):
(1)X的元素名称是 ,X的气态氢化物的电子式是 。
(2)Z元素在周期表中的位置是第 周期,第 族。Z和W形成的化合物属于 化合物(填“离子”或“共价”)。
(3)X、Y、Z、W的原子半径从大到小的顺序是 。
(4)X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是: 。
(5)铜和X的最高价氧化物的水化物的浓溶液反应的化学方程式: 。
(6)气体分子(YX)2称为拟卤素,性质与卤素类似,请写出(YX)2与NaOH溶液反应的化学方程式: 。
【答案】(1)氮![]()
(2)三 ⅦA 共价 (各1分,共3分)
(3)Al>Cl>C>N
(4)HClO4 >HNO3 >H2CO3
(5)Cu+4HNO3(浓)=Cu(NO3)2 +2NO2↑+2H2O
(6)(CN)2+2NaOH=NaCN+NaCNO+H2O
【解析】试题分析:X的单质由双原子分子构成,分子中有14个电子,X有多种氧化物,如XO、XO2等,因此X是N;Y原子的次外层电子数等于最外层电子数的一半,Y元素能形成多种单质,则Y是C;Z原子的最外层电子数多于4,Z元素的最高正化合价与最低负化合价的代数和等于6,则Z是Cl;W第三周期元素的简单离子中半径最小,W的单质化学性质虽较活泼,但只需常温保存,因此W是Al。
(1)根据以上分析可知X的元素名称是氮,X的气态氢化物是氨气,电子式是![]() 。
。
(2)氯元素在周期表中的位置是第三周期,第ⅦA族。Z和W形成的化合物氯化铝属于共价 化合物。
(3)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则X、Y、Z、W的原子半径从大到小的顺序是Al>Cl>C>N。
(4)非金属性越强,最高价含氧酸的酸性越强,则X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HClO4 >HNO3 >H2CO3。
(5)铜和X的最高价氧化物的水化物的浓溶液硝酸的反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2 +2NO2↑+2H2O。
(6)气体分子(CN)2称为拟卤素,性质与卤素类似,则根据卤素单质与氢氧化钠溶液反应的方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 元素周期律是元素原子核外电子排布周期性变化的结果
B. HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C. 第三周期非金属元素含氧酸的酸性从左到右依次增强
D. 形成离子键的阴、阳离子间只存在静电吸引力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )


A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向AlCl3溶液中滴加过量氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W是短周期界素中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置, 它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
(1)请写出Z在元素周期表中的位置为第 周期、第 族。
(2)气体分子YW2的电子式为 。
(3)由X、Y、Z、W四种元素可组成酸式盐,该化合物的水溶液与足量NaOH溶液在加热条件下反应的离子方程式为 。
(4)在一定条件下,由X单质与单质Z可化合生成E,工业上用E检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质Z生成,写出化学方程式 。该反应中被氧化的E与参与反应的E的质量之比 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质和用途描述正确的是( )
A.金属钠着火,可用水扑灭
B.自来水厂可用氯气来杀菌消毒,因此氯气无毒
C.Na2O2 可作为呼吸面具和潜水艇中氧气的来源
D.向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【无机工业流程】

实验室从含碘废液(除H2O外,含有CCl4、I2、I- 等)中回收碘,其实验过程如下:
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程为 ;该操作将I2还原为I- 的目的是 。
(2)操作X的名称为____________。

(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)已知:5SO![]() +2IO
+2IO![]() +2H+===I2+5SO
+2H+===I2+5SO![]() +H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO
+H2O,某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO![]() 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO![]() 的实验方案:取适量含碘废水用CCl4多次萃取、分液直到水层用淀粉溶液检验不出有碘单质存在;____________________
的实验方案:取适量含碘废水用CCl4多次萃取、分液直到水层用淀粉溶液检验不出有碘单质存在;____________________
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺(NH2Cl)、二氯胺(NHCl2)和三氯胺(NCl3)。氯胺消毒时首先发生水解,生成具有强烈杀菌作用的次氯酸。
(1)NH2Cl中氯元素的化合价为___________,其电子式为__________。
(2)NH2Cl水解的离子方程式为____________。
(3)三氯胺在常温下为黄色黏稠的油状液体,有毒,在弱酸性溶液中稳定性较好。将0.01 mol NCl3通入100mL0.5mol/LNa2S03溶液中,转移电子的物质的量为___________。
(4)己知:2NH3(g)+3C12(g)=N2(g)+6HCl(g)△H1=-469kJ/mol
N2(g)+3C12(g)=2NC13(g) △H2=+520kJ/mol
NH3(g)+3C12(g)= NC13(g)+ 3HCl(g)△H3
则△H3=__________kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
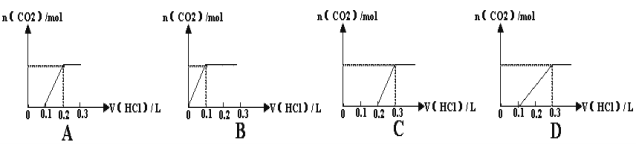
【题目】将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol·L--1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系是( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com