
【题目】下列曲线图(纵坐标为沉淀的量,横坐标为加入物质的量)与对应的选项相符合的是( )


A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 mol·L-1的稀H2SO4
B.向1 L浓度分别为0.1 mol·L-1和0.3 mol·L-1的AlCl3、NH4Cl的混合溶液中加入0.1 mol·L-1的稀NaOH溶液
C.向烧碱溶液中滴加明矾溶液
D.向AlCl3溶液中滴加过量氨水
【答案】A
【解析】
试题分析:A.向1L浓度均为0.1 molL-1的Ba(OH)2、NaAlO2混合溶液中加入0.1 molL-1的稀H2SO4,0.1molBa(OH)2消耗0.1mol硫酸,0.1molNaAlO2消耗0.05mol硫酸,硫酸过量时氢氧化铝溶解,0.1mol氢氧化铝消耗硫酸0.15mol,故A正确;B.向1L浓度分别为0.1 molL-1和0.3 molL-1的AlCl3、NH4Cl的混合溶液中加入0.1 molL-1的稀NaOH溶液,AlCl3与NaOH反应生成沉淀,然后氢氧化钠与氯化铵反应生成氨水,最后氢氧化铝与氢氧化钠反应,沉淀溶解,此时氢氧化铝与氢氧化钠的物质的量比为1:1,图象不符,故B错误;C.铝离子与过量的氢氧根离子反应生成偏铝酸根离子,偏铝酸根离子与铝离子反应生成氢氧化铝沉淀,偏铝酸根离子的物质的量是铝离子的,图象不符合,故C错误;D.向AlCl3溶液中滴加过量氨水,开始产生氢氧化铝沉淀,氨水过量时,沉淀不溶解,因为氢氧化铝不溶于氨水,图象不符合,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为原子序数依次增大的六种元素,A的一种同位素可用于考古测定生物的死亡年代,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数是A、B之和的2倍;F的原子序数为29。回答下列问题:
(1)六种元素中第一电离能最大的是 (填元素符号),其中D原子价电子排布图为 。
(2)基态E原子核外未成对电子数为 。
(3)BC2-的立体构型为 ,与其互为等电子体的分子是 (写化学式)。
(4)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因 ;F晶体的堆积方式为 (填序号)。
①简单立方堆积 ②体心立方堆枳 ③六方最密堆积 ④面心立方最密堆积
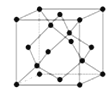
(5)硼与D可形成一种耐磨材料G,其结构与金刚石相似(如图),可由硼的三溴化物和D的三溴化物高温下在氢气的氛围中合成。G的晶胞边长为a Pm,则该晶体密度的表达式为 g· cm﹣3(含a、NA的式子表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。
Ca(OH)2+H2O2+6H2O![]() CaO2·8H2O,反应时通常加入过量的Ca(OH)2,其目的是____________。
CaO2·8H2O,反应时通常加入过量的Ca(OH)2,其目的是____________。
(2)向池塘水中加入一定里的CaO2·8H2O后,池塘水中浓度增加的离子有___________(填序号)。
A.Ca2+ B.H+ C.CO32- D.OH-
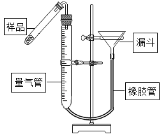
(3)CaO2在受热时能分解成CaO和O2。如图是测定样品中CaO2含量的装置。
①检查装置气密性的方法是:________________。
②加热小试管中的样品时,随着过氧化钙分解,量气瓶内的液面逐渐下降,为防止试管和量气瓶内气体压强过大,可将漏斗_______________(填“上提”或“下移”) 。
(4)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
![]()
写出O2将Mn2+氧化成MnO(O H)2的离了方程式:______________。
②取加过一定量CaO2·8H2O的池塘水样l00.00ml,按上述方注测定水中溶解氧量,消耗0.01000mol/L Na2S2O3标准溶液13.50 ml.计算该水样中的溶解氧(用mg·L-1表示), 写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装里如图所示(省略了净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
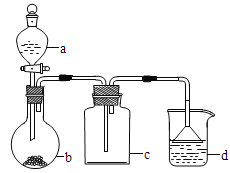
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 氯化按 | NaOH | NH3 | H2O |
B | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,其中A在常温下能与水发生剧烈反应,B是目前使用最多的金属。物质之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙 ; F ;
(2)写出下列反应的离子方程式:
①金属A和水反应的离子方程式 。
②D和G的水溶液反应的离子方程式 。
(3)将G浓溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在 之间,验证的简单方法是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.氯气通入氯化亚铁溶液中:Cl2+Fe2+=2Cl-+Fe3+
B.钠投入水中:Na+H2O=H2↑+Na++OH-
C.漂白粉的漂白原理:2ClO-+CO2+H2O=CO32-+2HClO
D.用小苏打治疗胃酸过多:HCO3-+H+=H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室备有质量分数为98%密度为1.84g·cm﹣3的硫酸.据此下列说法正确的是( )
A.该硫酸的物质的量浓度为16.4 molL﹣1
B.该硫酸50 mL与足量的铜反应可得到标准状况下SO2 0.46 mol
C.某同学用该硫酸配制稀硫酸时,未洗涤烧杯和玻璃棒,会造成最终配制的稀硫酸浓度偏低
D.等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W代表短周期的四种元素,有关它们的部分信息如下表所示:
元素 | 部分结构特点 | 部分性质 |
X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2等 |
Y | Y原子的次外层电子数等于最外层电子数的一半 | Y元素能形成多种单质 |
Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价的代数和等于6 |
W | 第三周期元素的简单离子中半径最小 | W的单质化学性质虽较活泼,但只需常温保存 |
请按要求回答下列问题(注意不能用字母X、Y、Z、W作答,请用相应的元素符号或化学式填写):
(1)X的元素名称是 ,X的气态氢化物的电子式是 。
(2)Z元素在周期表中的位置是第 周期,第 族。Z和W形成的化合物属于 化合物(填“离子”或“共价”)。
(3)X、Y、Z、W的原子半径从大到小的顺序是 。
(4)X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是: 。
(5)铜和X的最高价氧化物的水化物的浓溶液反应的化学方程式: 。
(6)气体分子(YX)2称为拟卤素,性质与卤素类似,请写出(YX)2与NaOH溶液反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下性质的比较中,正确的是( )
A.晶格能大小:NaI > NaBr> NaCl> NaF
B.单质的熔点:Li < Na < K < Rb
C.共价键的键能:C-C > C-Si > Si-Si
D.沸点高低:HF < HCl < HBr < HI
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com