
����Ŀ��A��B��C��D��E��FΪԭ�������������������Ԫ�أ�A��һ��ͬλ�ؿ����ڿ��Ųⶨ��������������Cԭ�ӵ������������Ǵ�����3����D��Bͬ���壻E��ԭ��������A��B֮�͵�2����F��ԭ������Ϊ29���ش��������⣺
��1������Ԫ���е�һ������������ ����Ԫ�ط��ţ�������Dԭ�Ӽ۵����Ų�ͼΪ ��
��2����̬Eԭ�Ӻ���δ�ɶԵ�����Ϊ ��
��3��BC2�������幹��Ϊ �����以Ϊ�ȵ�����ķ����� ��д��ѧʽ����
��4��FC�ڼ�������������ת��ΪF2C����ԭ�ӽṹ�ĽǶȽ���ԭ�� ��F����Ķѻ���ʽΪ ������ţ���
���������ѻ� �������������� ���������ܶѻ� �������������ܶѻ�
��5������D���γ�һ����ĥ����G����ṹ����ʯ���ƣ���ͼ��������������廯���D�����廯��������������ķ�Χ�кϳɡ�G�ľ����߳�Ϊa Pm����þ����ܶȵı���ʽΪ g�� cm��3����a��NA��ʽ�ӱ�ʾ�����ػ���
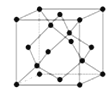
���𰸡���1��N��![]() ��
��
��2��4��
��3��V��SO2��O3����
��4��Cu2+������Χ�����Ų�Ϊ3d9����Cu+������Χ�����Ų�Ϊ3d10��Ϊȫ���ȶ�״̬��Cu2O���ȶ�������
��5��![]() ��
��
��������������������������Ϣ�ƶϣ�A��B��C��D��E��FΪԭ�������������������Ԫ�أ�A��һ��ͬλ�ؿ����ڿ��Ųⶨ��������������AΪ̼Ԫ�أ�Cԭ�ӵ������������Ǵ�����3����CΪ��Ԫ�أ�BΪ��Ԫ�أ�D��Bͬ���壬DΪ��Ԫ�أ�E��ԭ��������A��B֮�͵�2����EΪ��Ԫ�أ�F��ԭ������Ϊ29��FΪͭԪ�ء�
��1������Ԫ���е�һ������������N����ԭ�Ӽ۵����Ų�ͼΪ![]() ��
��
��2����Ϊ26��Ԫ�أ���̬��ԭ�ӵļ۵����Ų�ʽΪ3d64s2������δ�ɶԵ�����Ϊ4��
��3��NO2���е�ԭ��Ϊsp2�ӻ�������1�Թ¶Ե��ӣ������幹��ΪV�Σ����以Ϊ�ȵ�����ķ�����SO2��
��4��CuO�ڼ�������������ת��ΪCu2O��ԭ����Cu2+������Χ�����Ų�Ϊ3d9����Cu+������Χ�����Ų�Ϊ3d10��Ϊȫ���ȶ�״̬��Cu2O���ȶ���ͭ����Ķѻ���ʽΪ�����������ܶѻ���ѡ����
��5�����뵪���γ�һ����ĥ����BP�������侧���ṹ�����и����1�������к���4��B��4��P����1mol����������Ϊ4mol��42g/mol��1mol���������ΪNA����a��10-10cm��3����þ����ܶȵı���ʽΪ![]() ��
��


 ���ѵ����Ԫ��ĩ���100��ϵ�д�
���ѵ����Ԫ��ĩ���100��ϵ�д� ��˼άС�ھ�100����ҵ��ϵ�д�
��˼άС�ھ�100����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������֧�Թ��У���������ֽ�Ļ�ѧ��Ӧ���������ǣ� ��
�Թ� | �¶� | ��������Ũ�� | ���� |
A | ����(25��) | 12% | �� |
B | ˮԡ����(50��) | 4% | �� |
C | ˮԡ����( 50��) | 12% | �� |
D | ����(25��) | 4% | �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ػ�������ȡһ����ij�������ŷ�ˮ�����ֳɼס��ҡ��������ķݣ�������ͼ��ʾ̽����

��֪��ˮ�����п��ܺ����±��е����ӣ�
������ | Na����Mg2����X |
������ | Cl����SO��Y��NO |
��1������X��________(�ѧʽ����ͬ)������Y��________��
��2�����в���ȷ���Ƿ���ڵ���������________����֤�����������Ƿ���ڵļ�ʵ�����Ϊ______________________________________________
��3������ʵ��������������������Ӧ�����ӷ���ʽ��______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽ��ͼ��ʾ���йظ��л������������ȷ������ ��
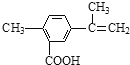
A����һ�������£��ܷ���ȡ���������������ͼӾ۷�Ӧ
B�������ʷ�������������11��̼ԭ����ͬһƽ����
C��1 mol������������4 mol H2�����ӳɷ�Ӧ
D��1 mol��������ȫ������������14mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������жϺ��������� ��
A��Na2O2��Fe2O3��A12O3���ڼ���������
B�����ǡ������ƺ����ᱵ�ֱ����ڷǵ���ʡ�ǿ����ʺ��������
C�����ݷ�ɢϵ�Ƿ���ж��������ɢϵ��Ϊ��Һ���������Һ
D�����ݷ�Ӧ���Ƿ��е��ӵ�ת�ƽ���ѧ��Ӧ��Ϊ������ԭ��Ӧ�ͷ�������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������ϢϢ��ء�����˵����ȷ������ ��
A��A12O3���ͻ��������Ϊ�������۵��
B��ҽ���ϣ�̼������������θ����һ��ҩ��
C�����ڳ�ʪ�Ŀ����з��ã�������ѧ��ʴ������
D��ʯӢ��ˮ����ˮ�ࡢ���ά�����ʵ���Ҫ�ɷ���SiO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ٶ�����̼���ŷ���һ����Ҫ���⡣
(1)CO2��������ɺϳɵ�̼ϩ����2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g) ��H
C2H4(g)+4H2O(g) ��H
��0.1 MPaʱ����![]() ��1��3Ͷ�ϣ�ͼ��ʾ��ͬ�¶�(T)�£�ƽ��ʱ��������̬���ʵ����ʵ���(n)�Ĺ�ϵ��
��1��3Ͷ�ϣ�ͼ��ʾ��ͬ�¶�(T)�£�ƽ��ʱ��������̬���ʵ����ʵ���(n)�Ĺ�ϵ��
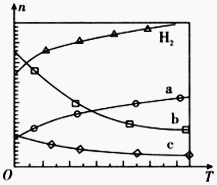
�ٸ÷�Ӧ�ġ�H__________0(�>������������<��)��
������b��ʾ������Ϊ__________��
��Ϊ���CO2��ƽ��ת���ʣ����ı��¶��⣬���ɲ�ȡ�Ĵ�ʩ��__________��
(2)��ǿ���Եĵ����ˮ��Һ�У����Բ������缫�����CO2�ɵõ�����ȼ�ϣ���ԭ����ͼ��ʾ��
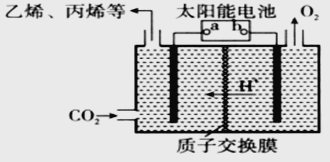
�ٸù���������ת����ʽ��Ҫ��_________��
��bΪ��Դ��________(���������)�������ʱ��������ϩ�ĵ缫��Ӧʽ��_________��
(3)��CO2Ϊԭ����ȡ̼(C)��̫���ܹ�����ͼ��ʾ��
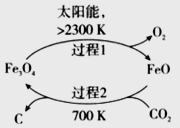
�ٹ���1ÿ��Ӧ1mol Fe3O4ת�Ƶ��ӵ����ʵ���Ϊ__________��
�ڹ���2������Ӧ�Ļ�ѧ����ʽ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. Ԫ����������Ԫ��ԭ�Ӻ�������Ų������Ա仯�Ľ��
B. HF��HCl��HBr��HI�����ȶ��Ժͻ�ԭ�Դ��������μ���
C. �������ڷǽ���Ԫ�غ���������Դ�����������ǿ
D. �γ����Ӽ������������Ӽ�ֻ���ھ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼ��������Ϊ����������������Ϊ�������ʵ��������Ӧ��ѡ������ϵ����� ��


A����1 LŨ�Ⱦ�Ϊ0.1 mol��L��1��Ba��OH��2��NaAlO2�����Һ�м���0.1 mol��L��1��ϡH2SO4
B����1 LŨ�ȷֱ�Ϊ0.1 mol��L��1��0.3 mol��L��1��AlCl3��NH4Cl�Ļ����Һ�м���0.1 mol��L��1��ϡNaOH��Һ
C�����ռ���Һ�еμ�������Һ
D����AlCl3��Һ�еμӹ�����ˮ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com