
 德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成(如图).请回答:C20分子共有
德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成(如图).请回答:C20分子共有| 1 |
| 3 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、苯和溴苯均为芳香烃 |
| B、酚醛树脂和聚乙烯均为体型高分子材料 |
| C、葡萄糖和麦芽糖均为还原性糖 |
| D、油脂和淀粉均为天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一,在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒,除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac
合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一,在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒,除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac查看答案和解析>>
科目:高中化学 来源: 题型:
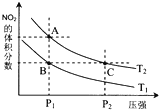 氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是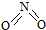 和
和 .实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的平均键能为466kJ?mol-1,N2O4中氮氧键的平均键能为438.5kJ?mol-1.
.实验测得N-N键键能为167kJ?mol-1,NO2中氮氧键的平均键能为466kJ?mol-1,N2O4中氮氧键的平均键能为438.5kJ?mol-1.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学用如图所示的装置研究不同电解质溶液中Mg和Al的活泼性.请回答下列问题:
某同学用如图所示的装置研究不同电解质溶液中Mg和Al的活泼性.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液、蒸馏、渗析、层析及色谱法、钠融法等都是混合体系分离提纯常用的方法 |
| B、检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 |
| C、以下六种无色溶液:医用酒精、福尔马林、蚁酸溶液、甘油溶液、葡萄糖溶液、稀硫酸,用新制Cu(OH)2悬浊液及简单的实验操作即可一一鉴别 |
| D、淀粉与20%的硫酸混合溶液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com