
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是( )
A.10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl﹣>c(NH ![]() )>c(OH﹣)>c(H+)
)>c(OH﹣)>c(H+)
B.10 mL 0.1 mol/L NH4Cl溶液与5mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl﹣)>c(OH﹣)>c(H+)
C.10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO﹣)>c(OH﹣)>c(H+)
D.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl﹣)>c(Na+)>c(OH﹣)>c(H+)
【答案】B
【解析】解:A.物质的量相同的氨水和盐酸混合,二者恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,但其水解程度较小,所以离子浓度大小顺序是c(Cl﹣>c(NH ![]() )>c(H+)>c(OH﹣),故A错误; B.10 mL 0.1 mol/L NH4Cl溶液与5mL 0.2 mol/L NaOH溶液混合,二者恰好反应生成氯化钠和一水合氨,一水合氨电离导致溶液呈碱性,c(OH﹣)>c(H+),但其水解程度较小,根据物料守恒得c(Na+)=c(Cl﹣),离子浓度大小顺序是c(Na+)=c(Cl﹣)>c(OH﹣)>c(H+),故B正确;
)>c(H+)>c(OH﹣),故A错误; B.10 mL 0.1 mol/L NH4Cl溶液与5mL 0.2 mol/L NaOH溶液混合,二者恰好反应生成氯化钠和一水合氨,一水合氨电离导致溶液呈碱性,c(OH﹣)>c(H+),但其水解程度较小,根据物料守恒得c(Na+)=c(Cl﹣),离子浓度大小顺序是c(Na+)=c(Cl﹣)>c(OH﹣)>c(H+),故B正确;
C.10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合,二者物质的量相等,二者恰好反应生成醋酸钠,醋酸根离子水解导致溶液呈碱性,所以得c(Na+)>c(CH3COO﹣)、c(OH﹣)>c(H+),但其水解程度较小,离子浓度大小顺序是c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+),故C错误;
D.10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合,盐酸的物质的量大于醋酸钠,盐酸过量,反应后溶液中溶质为醋酸、氯化钠、盐酸,溶液呈酸性,则c(H+)>c(OH﹣),根据物料守恒得c(Cl﹣)>c(Na+),离子浓度大小顺序是c(Cl﹣)>c(Na+)>c(H+)>c(OH﹣),故D错误;
故选B.


科目:高中化学 来源: 题型:
【题目】氯的氧化物是氯与氧的二元化合物的总称,也称为氧化氯.目前Cl2O、ClO2、Cl2O7已能制取.有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
相对分子质量 | 87 | 67.5 | 183 |
沸点/℃ | 2 | 9.7 | 81 |
完成下列填空:
(1)Cl2O是酸的酸酐,Cl2O电子式为 .
(2)下列能判断Cl和O两种元素非金属性强弱的是(选填编号).
a.氧化氯的分子式 b.与金属反应得电子的数目
c.气态氢化物的稳定性 d.最高价氧化物对应水化物的酸性
(3)根据分子间作用力对沸点影响的变化规律:组成和结构相似的分子,其沸点随着相对分子质量的增大而升高,但上表中相对分子质量是Cl2O7>Cl2O>ClO2 , 其沸点的变化不是Cl2O7>Cl2O>ClO2的原因是
(4)ClO2和碱溶液反应生成亚氯酸盐(阴离子是ClO2﹣)和氯酸盐,其离子方程式是 , 氧化产物 . (填离子符号)
(5)一定条件下,在水溶液中1mol Cl﹣、ClO ![]() (x=1,2,3,4)的能量(kJ)相对大小如图所示.D是(填离子符号).B→A+C的热化学方程式为(用离子符号表示).
(x=1,2,3,4)的能量(kJ)相对大小如图所示.D是(填离子符号).B→A+C的热化学方程式为(用离子符号表示). 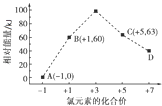
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 2.3 g 钠放入 91.8 g 水中,反应完全后,溶液中 Na+与 H2O 的分子个数比为( )
A. 1︰30 B. 1︰40 C. 1︰50 D. 1︰25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国外宇航员吃着“牙膏和砖块”时,中国宇航员已经在太空泡茶了,每个茶装在特制包装袋中,注水后用加热器进行加热就可以喝了,但要插上吸管以防止水珠飘起来。下列说法正确的是( )
物质 | 氧化镁 | 氯化镁 |
熔点/℃ | 2 852 | 714 |
A. 宇航员喝茶时注入的H2O的摩尔质量是18克
B. H2O+Cl2![]() HCl+HClO这反应属于氧化还原反应
HCl+HClO这反应属于氧化还原反应
C. 氢的三种同位素1H、2D、3T与16O只能形成三种水分子
D. 在标准状况下,1mol水的体积约是22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应.根据要求回答下列问题.
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用方程式表示:盐碱地产生碱性的原因:;
农业上用石膏降低其碱性的反应原理: .
(2)已知水存在如下平衡:H2O+H2OH3O++OH﹣ , 向水中加入NaHSO4固体,水的电离平衡向移动,且所得溶液显性.
(3)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则mn(填“>”、“<”或“=”).
(4)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH﹣)= .
(5)在图中画出用0.100 0molL﹣1 NaOH溶液滴定20.00 mL 0.100molL﹣1盐酸的滴定曲线示意图 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)2.6H2O,下列有关离子方程式错误的是( )
A.通入足量的溴水:2Fe2++Br2=2Fe3++2Br﹣
B.先加盐酸在通入BaCl2溶液:SO ![]() +Ba2+=BaSO4↓
+Ba2+=BaSO4↓
C.加氢氧化钠固体加热:NH ![]() +OH﹣=NH3↑+H2O
+OH﹣=NH3↑+H2O
D.检验该溶液是否变质:Fe3++3SCN﹣=Fe(SCN)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验的实验装置如图所示,回答下列有关该实验的问题。
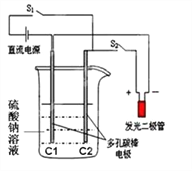
(1)该实验所用的石墨棒须经过预处理;先经高温火焰灼烧到红热,再迅速浸入冷 水中。这种预处理的目的是:_____。
(2)要使发光二极管发亮,实验时的操作顺序是:先关闭 S1,打开 S2,电解一段时 间后,再打开 S1,关闭 S2 ,请写出整个实验过程中的能 量转化形式_____
(3)写出下列操作时的电极反应式,并注明电极名称:
① 按下开关 S1:C1 附近发生 2H2O+2e— =H2↑+2OH— 的电极反应
② 断开开关 S1,迅速按下开关 S2:(提示:此时 C1 附近溶液显碱性,C2 附近溶液显酸性)
C2 _____,_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com