
【题目】在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是
A.n(Cl2)∶n(Fe)=5∶4;5Cl2+4Fe![]() 2FeCl2+2FeCl3
2FeCl2+2FeCl3
B.n(Cl2)∶n(FeBr2)=1∶1;Fe2++2Br+Cl2=Fe3++Br2+2Cl
C.n(MnO4-)∶n(H2O2)=2∶3;2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
D.n(Fe) ∶n[HNO3(稀)]=1∶3;4Fe+12H++3NO3-=3Fe2++Fe3++3NO↑+6H2O
【答案】D
【解析】
A.Fe与氯气反应与量无关,对应反应为3Cl2+2Fe![]() 2FeCl3,A错误;
2FeCl3,A错误;
B. n(Cl2)∶n(FeBr2)=1∶1,Fe2+全部被氧化为Fe3+,Br-有一半被氧化为Br2,对应离子反应为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,B错误;
C. n(MnO4-)∶n(H2O2)=2∶3时,不遵循电子守恒,则n(MnO4-):n(H2O2)=2:5时对应离子反应为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,C错误;
D.n(Fe) ∶n[HNO3(稀)]=1∶3,由电子守恒可知,生成Fe2+和Fe3+,NO3-被还原产生NO气体,结合电荷守恒及原子守恒,可得离子反应为4Fe+12H++3NO3-=3Fe2++Fe3++3NO↑+6H2O,D正确;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】M、R均为主族元素,已知M的一个原子失去2个电子,R的一个原子得到1个电子后形成稀有气体元素的电子层结构。下列关于M与R形成的化合物的叙述正确的是( )
A. M与R可以形成MR2型离子化合物
B. 在MR2中M的离子半径比R的离子半径大
C. 形成的两种离子分别是M+和R2-
D. MR2的电子式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白头翁素具有显著的抗菌作用,其合成路线如图所示:
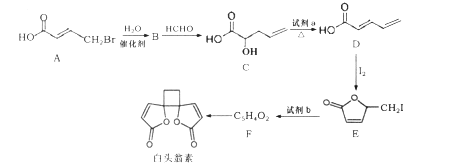
已知:
①RCH2Br![]() RCH=CHR’
RCH=CHR’
②2RCH=CHR’![]()
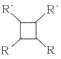
(以上R、R’代表氢、烷基)
(1)白头翁素的分子式为____。
(2)试剂a为______,E→F的反应类型为________。
(3)F的结构简式为_________。
(4)C中含有的官能团名称为________。
(5) A→B反应的化学方程式为_________。
(6)F与足量氢气加成得到G,G有多种同分异构体,其中属于链状羧酸类有____种。
(7)以乙烯为起始原料,选用必要的无机试剂合成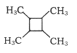 的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示装置的叙述,错误的是( )

A. 锌是负极,其质量逐渐减小B. 氢离子在铜表面被还原,产生气泡
C. 电子从锌片经硫酸溶液流向铜片D. 电子从锌片经导线流向铜片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】爱迪生蓄电池在充电和放电时发生的反应为Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2,下列对该蓄电池的推断错误的是( )
Fe(OH)2+Ni(OH)2,下列对该蓄电池的推断错误的是( )
①放电时,Fe参与负极反应,NiO2参与正极反应
②放电时,电解质溶液中的阴离子向正极移动
③放电时,负极上的电极反应式为Fe+2H2O-2e-=Fe(OH)2+2H+
④该蓄电池的电极必须浸入某种碱性电解质溶液中
A.①②B.②③C.①③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
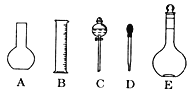
【题目】实验室用浓硫酸配制1.0mol/L硫酸溶液480mL,回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 ______(填字母),配制上述溶液还需用到的玻璃仪器是_________(填仪器名称)。
(2)容量瓶上标有以下5项中的_____(填序号)
①压强 ②温度 ③容量 ④浓度 ⑤刻度线
(3)在配制过程中,下列操作使所配溶液浓度偏大的是__________ .
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
③定容时,仰视刻度线
④使用容量瓶前用蒸馏水洗涤且没干燥
(4)计算实验室配制上述溶液需用量筒量取质量分数为98%、密度为1.84g/mL的浓硫酸的体积为:_____mL。(保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、X、N、Z、Y原子序数依次增大的短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X,Y既不同族,也不同周期。X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6。N是短周期主族元素中原子半径最大的非金属元素。
(1)请写出下列元素的元素名称:X________,M________。
(2) Y在周期表中的位置______________,写出Z的氢化物的电子式_____________
(3) N的氧化物与氢氧化钠溶液反应的化学方程式_________________。
(4)Y与Z的最高价氧化物对应水化物的酸性强弱顺序________>________(用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.0.1 mol N2的质量是2.8 g
B.常温常压下,22 g CO2中所含氧原子数约为6.02×1023
C.2 L 0.1mol·L-1NaCl溶液中,c(Na+)=0.2mol·L-1
D.标准状况下,11.2 L O2含有的原子数目约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
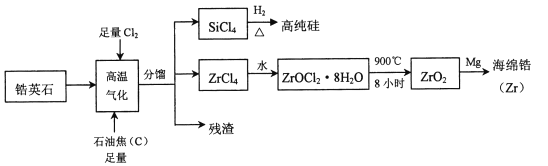
【题目】锆(![]() )是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是
)是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是![]() ,还含有少量
,还含有少量![]() 等杂质)为原料生产锆及其化合物的流程如图所示
等杂质)为原料生产锆及其化合物的流程如图所示
(1)写出![]() 的电子式____________________。
的电子式____________________。
(2)高温气化过程中,不考虑损失,发现分馏后得到的![]() 质量通常比由纯
质量通常比由纯![]() 发生的反应得到的
发生的反应得到的![]() 质量大,用化学方程式来解释原因_________________________。
质量大,用化学方程式来解释原因_________________________。
(3)高温气化后的固体残渣除碳外,还有![]() 和
和![]() ,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和
,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和![]() 两种固体的方法是____________________。
两种固体的方法是____________________。
(4)写出上述流程中![]() 与水反应的化学方程式:____________________________。
与水反应的化学方程式:____________________________。
(5)已知氧化锆(![]() )是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
)是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
(6)工业上可用钾还原![]() 时制得金属
时制得金属![]() ,
,![]() 被还原时生成的钾盐的物质的量为_________________。
被还原时生成的钾盐的物质的量为_________________。
(7)已知![]() ,
,![]() 。下列说法正确的是__________
。下列说法正确的是__________
A.![]() ,电解质溶液的
,电解质溶液的![]() 与
与![]() 之和均为14
之和均为14
B.用盐酸滴定某浓度的![]() 溶液,滴定过程中
溶液,滴定过程中![]() 逐渐增大
逐渐增大
C.![]() 溶液中逐滴加入硫酸溶液,滴加过程中
溶液中逐滴加入硫酸溶液,滴加过程中![]() 逐渐减小
逐渐减小
D.某温度下![]() ,则其溶液中
,则其溶液中![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com