
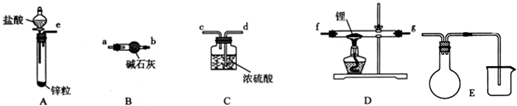
���� ��1��������﮷�����Ӧ����LiH���Ʊ�LiH������Ҫ�Ʊ�������LiH�ڸ���Ŀ��������ȶ����ڣ���ˮ�����ܹ�����ȼ�գ������Ʊ��õ�������������﴿��������Aװ���Ʊ���������װ��B�еļ�ʯ�ҳ�ȥ�����е��Ȼ����ˮ������ͨ��װ��D�м��Ⱥ�﮷�Ӧ�����⻯ﮣ��������װ��C����ֹ�����е�ˮ�����Ͷ�����̼����װ��D�����ɵ��⻯﮷�����Ӧ��
�Ʊ�����װ�ã�����ҩƷǰ����Ҫ���е�ʵ������ǣ�����װ�������ԣ�
��2��ʯ�����л�����ܽ����л��ܼ��ױ���
��3��ʹ��ǰӦͨ��һ��ʱ���������ž�װ���ڵĿ�������ֹ����ʱ��������������ըΣ�գ�
��4��LiH��H2O����ˮ�ⷴӦ������ӽ�����������ӣ��⸺�����������ӽṹ����������LiH���Ҵ���Ӧ���ƣ��ǻ��ṩHԭ����LiH��Ӧ�������������ⲿ�ֽ������CH3CH2OLi��
��5����LiH��Li�����ʵ����ֱ�Ϊxmol��ymol�����ݷ���ʽ��ʾ���������������ʵ������ٸ��ݶ���������������������з��̼�����
��6��װ��E�����ռ�H2�����õ�������ƿ���ռ����������Ը�����ˮ���������װ�ã������ܶ̽�������
��� �⣺��1��������﮷�����Ӧ����LiH���Ʊ�LiH������Ҫ�Ʊ�������LiH�ڸ���Ŀ��������ȶ����ڣ���ˮ�����ܹ�����ȼ�գ������Ʊ��õ�������������﴿��������Aװ���Ʊ���������װ��B�еļ�ʯ�ҳ�ȥ�����е��Ȼ����ˮ������ͨ��װ��D�м��Ⱥ�﮷�Ӧ�����⻯ﮣ��������װ��C����ֹ�����е�ˮ�����Ͷ�����̼����װ��D�����ɵ��⻯﮷�����Ӧ��װ������˳��Ϊ��e��a��b��f��g��d��f��g����Ҳ���ԣ���
�Ʊ�����װ�ã�����ҩƷǰ����Ҫ���е�ʵ������ǣ�����װ�������ԣ�
װ��B�м�ʯ���������ƺ��������ƵĻ�����������ˮ�ɷ�Ӧ���������ƿ�������������������ܷ�Ӧ�����Ը�װ�õ�����������ˮ�����Ͳ����Ȼ������壬
�ʴ�Ϊ��e��a��b��f��g��d��f��g����Ҳ���ԣ�������װ�������ԣ���ȥH2�е�H2O��HCl��
��2��ȡ��һ��������ﮣ�����ʯ���ܷ⣩��Ȼ���ڼױ��н�ϴ���Σ�����ʯ�����л������ܽ����л��ܼ��ױ��У�������Ŀ���dz�ȥﮱ����ʯ����
�ʴ�Ϊ����ȥﮱ����ʯ����
��3��ʹ��ǰӦͨ��һ��ʱ���������ž�װ���ڵĿ�������ֹ����ʱ��������������ըΣ�գ��ڼ���D����ʯӢ��֮ǰ��������е�ʵ������ǣ��ռ�c���ų������岢����H2���ȣ�
�ʴ�Ϊ���ռ�c���ų������岢����H2���ȣ�
��4��LiH��H2O����ˮ�ⷴӦ������ӽ�����������ӣ��⸺�����������ӽṹ����������LiH���Ҵ���Ӧ���ƣ��ǻ��ṩHԭ����LiH��Ӧ�������������ⲿ�ֽ������CH3CH2OLi����Ӧ����ʽΪ��LiH+CH3CH2OH=CH3CH2OLi+H2����
�ʴ�Ϊ��LiH+CH3CH2OH=CH3CH2OLi+H2����
��5����LiH��Li�����ʵ����ֱ�Ϊxmol��ymol����
LiH+H2O=H2��+LiOH
xmol xmol
2Li+2H2O=2LiOH+H2��
ymol 0.5y mol
$\left\{\begin{array}{l}{8x+7y=0.174g}\\{x+0.5y=\frac{0.4704L}{22.4L/mol}}\end{array}\right.$���x=0.02��y=0.002
��LiH��Li�����ʵ���֮��Ϊ0.02mol��0.002mol=10��1��
�ʴ�Ϊ��10��1��
��6��װ��E�����ռ�H2�����õ�������ƿ���ռ����������Ը�����ˮ���������װ�ã������ܶ̽�������װ��ͼΪ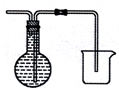 ��
��
�ʴ�Ϊ�� ��
��
���� ���⿼�黯ѧʵ���Ʊ�����������ԭ���ǽ���ؼ����漰��װ�ü������ķ������ۡ������ռ�����ѧ����ʽ�ļ���ȣ���Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��� | B�� | ���ʯ��ʯ��ʯӢɰ | ||
| C�� | �����ʯ��ʯ | D�� | �������衢����ơ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

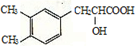 +NaHCO3
+NaHCO3
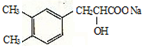 +CO2��+H2O��
+CO2��+H2O��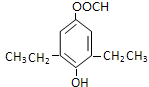 ��
��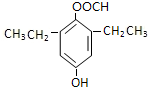 ��
��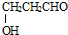 �������
����д����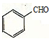 ��CH3CH2OHΪԭ�Ϻϳ�
��CH3CH2OHΪԭ�Ϻϳ� ��·������ͼ�����Լ�����ѡ�����ϳ�·������ͼ���£�
��·������ͼ�����Լ�����ѡ�����ϳ�·������ͼ���£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
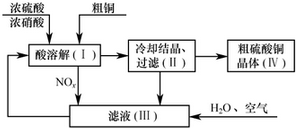
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ƽ��������Ӧ�����ƶ� | B�� | m+n��p | ||
| C�� | ����A��ת�������� | D�� | C���������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
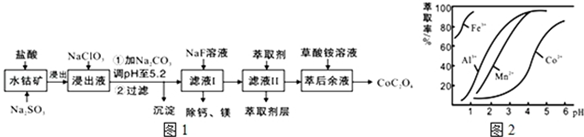
| ������ | Fe��OH��3 | Fe��OH��2 | Co��OH��2 | Al��OH��3 | Mn��OH��2 |
| ��ȫ������pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
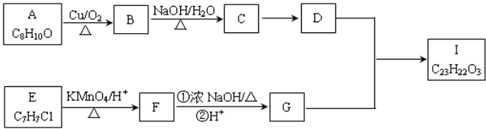
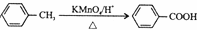
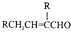
 ��
�� ��
��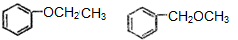 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
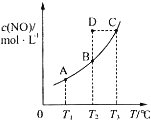 ���ݻ�һ�����ܱ������У�����һ������һ������������̼������ѧ��Ӧ��
���ݻ�һ�����ܱ������У�����һ������һ������������̼������ѧ��Ӧ��| A�� | �÷�Ӧ��Q��0 | |
| B�� | ���÷�Ӧ��T1��T2ʱ��ƽ�ⳣ���ֱ�ΪK1��K2����K1��K2 | |
| C�� | ��T2ʱ������Ӧ��ϵ����״̬D�����ʱV����V�� | |
| D�� | ��״̬B��C��D��ѹǿ�ֱ�ΪPB��PC��PD���� PC=PD��PB |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com