
【题目】(1)对于下列反应:2SO2+O2 2SO3,如果 2min 内 SO2 的浓度由 6mol/L 下降为 2mol/L,那么,用 SO2 浓度变化来表示的化学反应速率为______,用 O2 浓度变化来表示的反应速率为______。如果开始时 SO2 浓度为 4mol/L,2min 后反应达平衡,若这段时间内v(O2)为 0.5mol/(Lmin),那么 2min 时 SO2 的浓度为______。
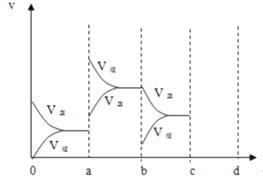
(2)下图表示在密闭容器中反应:2SO2+O2![]() 2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab 过程中改变的条件可能是___________;bc 过程中改变的条件可能是____________;若在 c 时刻增大压强,画出 c~d 时刻反应速率变化情况____________。
2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab 过程中改变的条件可能是___________;bc 过程中改变的条件可能是____________;若在 c 时刻增大压强,画出 c~d 时刻反应速率变化情况____________。
【答案】 2mol/L.min-1;; 1mol/L.min-1 2mol/L 升高温度 减少 SO3 的浓度 
【解析】本题主要考查影响化学反应速率的因素。
(1)对于下列反应:2SO2+O22SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为(6mol/L-2mol/L)/2min=2mol/L.min-1,用 O2浓度变化来表示的反应速率为SO2的1/2为1mol/L.min-1。如果开始时 SO2 浓度为 4mol/L,2min 后反应达平衡,若这段时间内v(O2)为 0.5mol/(Lmin),由此可知O2的物质的量浓度减少1mol/L,相应地SO2的物质的量浓度减少2mol/L,那么 2min 时 SO2 的浓度为2mol/L。
(2)a时刻正、逆反应速率都增大,而且逆反应速率增大程度更大,说明ab过程中改变的条件可能是升高温度;b时刻逆反应速率减小,正反应速率不变,所以bc 过程中改变的条件可能是减少 SO3 的浓度;若在 c 时刻增大压强,c~d 时刻反应速率变化情况为: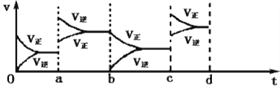 。
。


科目:高中化学 来源: 题型:
【题目】下列描述,其因果关系成立的是
A.因为NH3的水溶液可以导电,所以NH3是电解质
B.因为SO2可以使溴水褪色,所以SO2具有漂白性
C.因为某碱性溶液的焰色呈黄色,所以其溶质为NaOH
D.因为电解质溶于水后电离为离子,所以电解质在溶液中的反应实质是离子反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中存在的碘的稳定性核素是碘﹣127( ![]() I).日本福岛第一核电站事故释放出的放射性物质中,含有人工放射性核素碘﹣131(
I).日本福岛第一核电站事故释放出的放射性物质中,含有人工放射性核素碘﹣131( ![]() I).碘﹣131 (
I).碘﹣131 ( ![]() I) 一旦被人体吸入,就可能会引发甲状腺疾病.对于这两种核素的下列说法正确的是( )
I) 一旦被人体吸入,就可能会引发甲状腺疾病.对于这两种核素的下列说法正确的是( )
A.![]() I是一种新元素
I是一种新元素
B.![]() I的摩尔质量为131g
I的摩尔质量为131g
C.![]() I和
I和 ![]() I互为同位素
I互为同位素
D.![]() I中子数与质子数之差为74
I中子数与质子数之差为74
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质发生的变化,所克服的微粒间作用,属于同一类型的是
A.苯和己烷的挥发B.二氧化硅和生石灰的熔化
C.氯化钠和铁的熔化D.氯化钠和氯化氢的溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与过量的锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是___________________;并用简单的装置图来表明你所阐述的理由______________________________;
(2)要加快上述实验中气体产生的速率,还可采取的措施有_______________;
(3)下列物质的加入能减慢氢气生成速率但不影响生成氢气的体积的是_____
A.加入碳酸钠溶液 B.加入硫酸钠溶液
C.加入硝酸钠溶液 D.加入醋酸钠溶液
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到 6 个盛有过量 Zn 粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
混合溶液实验 | 1 | 2 | 3 | 4 | 5 | 6 |
4mol·mol-1H2SO4/mL | 40 | V1 | V2 | V3 | V4 | V5 |
饱和 CuSO4 溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V6、V8 分别是_____________;
②该同学最后得出的结论为:当加入少量 CuSO4 溶液时,生成氢气的速率会大大提高,随着加入的 CuSO4 溶液增多时,生成氢气的速率会______(填加快、减慢或不变)。理由___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物![]() 蒸气密度是相同状态下甲烷密度的
蒸气密度是相同状态下甲烷密度的![]() 倍,完全燃烧的产物只有二氧化碳和水,元素组成分析发现,该物质中碳元素的质量分数为
倍,完全燃烧的产物只有二氧化碳和水,元素组成分析发现,该物质中碳元素的质量分数为![]() ,氢元素的质量分数为氢
,氢元素的质量分数为氢![]() 它的核磁共振氢谱有
它的核磁共振氢谱有![]() 组明显的吸收峰。下列关于有机物
组明显的吸收峰。下列关于有机物![]() 的说法不正确的是
的说法不正确的是
A. 含有![]() 、
、![]() 、
、![]() 三种元素
三种元素
B. 分子组成为![]()
C. 结构简式可能为![]()
D. 分子中可能同时含有![]() ,
, ![]() ,
,![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com