
| A. |  | B. | 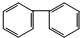 | C. | 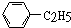 | D. |  |
分析 芳香烃通常指分子中含有苯环结构的碳氢化合物;
同系物指结构相似,在分子组成上相差一个或若干个CH2原子团的物质;
苯的同系物含有1个苯环,侧链为烷基,组成通式为CnH2n-6.
解答 解:A.是含有苯环结构的碳氢化合物,属于芳香烃,侧链是乙烯基,含有双键,不是烷基,不是苯的同系物,故A错误;
B.是含有苯环结构的碳氢化合物,属于芳香烃,分子中含有2个苯环,不相差若干个CH2原子团,不是苯的同系物,故B错误;
C.是含有苯环结构的碳氢化合物,属于芳香烃,侧链是乙基,分子组成比苯多2个CH2原子团,是苯的同系物,故C正确;
D.是含有苯环结构的碳氢化合物,属于芳香烃,分子中含有2个苯环,不相差若干个CH2原子团,不是苯的同系物,故D错误;
故选C.
点评 本题考查芳香烃、苯的同系物的概念、难度不大.要注意苯的同系物结构特点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
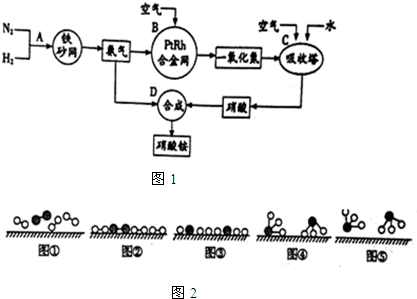
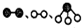 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面;在催化剂表面N2、H2中的化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是N2、H2被吸附在催化剂表面;在催化剂表面N2、H2中的化学键断裂.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲同学认为氯化铵由N、H、Cl三种元素组成 | |
| B. | 乙同学认为一个氯化铵分子中含有一个NH4+和一个Cl- | |
| C. | 丙同学认为氯化铵由NH4+和Cl-构成 | |
| D. | 丁同学认为氯化铵中阴、阳离子个数比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池的正极为锌 | |
| B. | 电池正极反应式为:MnO2+e-+H2O═MnO(OH)+OH- | |
| C. | 该电池反应中二氧化锰起催化剂作用 | |
| D. | 当 0.l mol Zn 完全溶解时,流经电解液的电子数目为 1.204×l023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:H2SiO3>H2CO3>H3PO4 | B. | 稳定性:PH3<H2S<HCl<HF | ||
| C. | 非金属性:Cl>S>P>Si | D. | 离子半径:Cl->F->Na+>Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
 ,①、②、③原子半径从大到小的顺序是①②③
,①、②、③原子半径从大到小的顺序是①②③查看答案和解析>>
科目:高中化学 来源: 题型:填空题
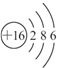 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com