
| A. | 氨水能跟H2SO4反应生成(NH4)2SO4 | B. | 铵盐受热易分解 | ||
| C. | 0.1mol/L的氨水可使酚酞试液变红 | D. | 25℃,0.1mol/L氨水的pH约为12 |
分析 溶液中存在电解质分子与电解质离子之间的平衡,说明电解质属于弱电解质,
A.强碱、弱碱都能与硫酸发生中和反应;
B.铵盐受热易分解,说明铵盐不稳定,与氨水呈碱性及强弱无关
C.酚酞试液变红,说明溶液呈碱性,不能说明具体的pH值;
D.若为强碱溶液,0.1mol/L氨水溶液的pH为13.
解答 解:A.氨水能跟H2SO4反应生成(NH4)2SO4,说明氨水呈碱性,不能说明氨水是弱碱,故A错误;
B.铵盐受热易分解,说明铵盐不稳定,与氨水呈碱性及强弱无关,故B错误;
C.0.1mol/L氨水可以使酚酞试液变红,说明氨水呈碱性,不能说明氨水是弱碱,故C错误;
D.室温下,0.1mol/L氨水溶液的pH约为12,说明一水合氨没有完全电离,所以它为弱碱,故D正确;
故选D.
点评 本题考察强弱电解质的判断,难度不大,注意强弱电解质的本质在于电解质是否完全电离.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
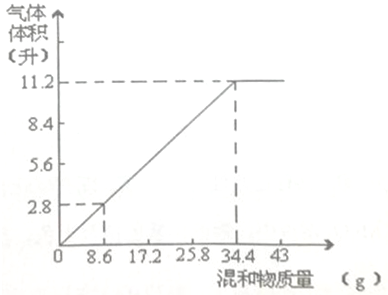 加热碳酸铵[(NH4)2CO3】并使产物全部变成气态.
加热碳酸铵[(NH4)2CO3】并使产物全部变成气态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变时,增大反应的物质的量,反应速率增大,化学平衡发生移动 | |
| B. | 其他条件不变时,升高温度,化学平衡向放热反应的方向移动 | |
| C. | 其他条件不变时,增大压强,化学反应速率增大,化学平衡发生移动 | |
| D. | 其他条件不变时,使用催化剂,化学反应速率改变,化学平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.
以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.| 阳离子 | Fe3+ | Fe2+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | |
| 沉淀完全的pH | 3.7 | 9.6 | 9(>9)溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,其分子式是C9H10O3,含氧官能团的名称是:羧基、醇羟基.
,其分子式是C9H10O3,含氧官能团的名称是:羧基、醇羟基.
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化,持续通入一段时间后,CCl4层变为棕色 | ⑨单质、Br2、Fe3+的氧化性由强到弱的顺序是: ⑨单质(或Cl2)>Br2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com