
【题目】由单质A与化合物B两种粉末组成的混合物,在一定条件下可按如图所示发生转化:
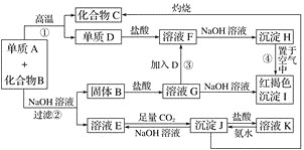
请回答:
(1)A、B的化学式分别为________、________。
(2)反应①的化学方程式:_____________________________________________________。
(3)写出反应②③的离子方程式:
②________________________________________________________________________;
③________________________________________________________________________。
【答案】Al Fe2O3 Fe2O3+2Al![]() Al2O3+2Fe 2Al+2OH-+2H2O===2AlO2—+3H2↑ 2Fe3++Fe===3Fe2+
Al2O3+2Fe 2Al+2OH-+2H2O===2AlO2—+3H2↑ 2Fe3++Fe===3Fe2+
【解析】
红褐色沉淀I为Fe(OH)3,沉淀H置于空气中变成I,推出H为Fe(OH)2,再利用其他信息和逆向推理得出D为Fe,F为FeCl2,B为Fe2O3,G为FeCl3;沉淀J既能与酸反应,又能与碱反应,则应为Al(OH)3,则E为NaAlO2,K为AlCl3,则单质A与化合物B两种粉末组成的混合物在高温下的反应,应为铝热反应,推出A为Al,B为Fe2O3,C为Al2O3,据此分析解答。
(1)由以上分析可知A为Al,B为Fe2O3,故答案为:Al;Fe2O3;
(2)反应①为Al和Fe2O3在高温下的铝热反应,反应的化学方程式为2Al+Fe2O3![]() 2Fe+Al2O3,故答案为:2Al+Fe2O3
2Fe+Al2O3,故答案为:2Al+Fe2O3![]() 2Fe+Al2O3;
2Fe+Al2O3;
(3)Al和Fe2O3混合物中,只有Al能和NaOH溶液反应,反应②为Al与NaOH溶液反应,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;D为Fe,F为FeCl2,G为FeCl3,Fe3+具有强氧化性,能与Fe反应生成Fe2+,反应③的离子方程式为Fe+2Fe3+=3Fe2+,故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;Fe+2Fe3+=3Fe2+。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组进行氢氧化铁胶体的制备实验并检验其性质。请回答下列问题:
(1)若将饱和氯化铁溶液分别滴入下列物质中,能形成胶体的是______________(填字母,下同)。
A.冷水 B.沸水 C.氢氧化钠浓溶液 D.氯化钠浓溶液
(2)甲、乙、丙三名同学进行氢氧化铁胶体的制备操作如下,其正确的是____________。
A.甲同学取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL 氯化铁饱和溶液,继续煮沸至混合液呈红褐色,停止加热
B.乙同学直接加热饱和氯化铁溶液
C.丙同学向沸水中滴加饱和氯化铁溶液,为了使反应进行充分,煮沸10分钟
(3)写出制备氢氧化铁胶体的化学方程式________________________________。
(4)证明有氢氧化铁胶体生成的实验操作是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于电解池应用的规律提炼题组某化学兴趣小组用下图所示装置进行电化学原理的实验探究,回答下列问题:
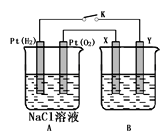
(1)通O2的Pt电极为电池__________极(填电极名称),其电极反应式为______________。
(2)若B电池为电镀池,目的是在某镀件上镀一层银,则X电极材料为_________,电解质溶液为__________。
(3)若B电池为精炼铜,且粗铜中含有Zn、Fe、Ag、Au等杂质,在__________电极(填“X”或“Y”)周围有固体沉积成阳极泥,阳极泥的成分为___________。
(4)若X、Y均为Pt,B电池的电解质溶液为500 mL 1.0mol/L的NaCl溶液,当电池工作一段时间断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全逸出,溶液体积不变)。恢复到常温下,B电池溶液的pH=___________,要使该溶液恢复到原来的状态,需加入__________(填物质并注明物质的量)。
(5)若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为_______________。
(学法题)通过以上题目,请总结书写电极反应式的关键____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 2NO2(g)+ CH4(g)![]() N2(g)+ CO2(g)+ 2H2O(g) ΔH,向容积为2L的恒容密闭容器中,充入NO2和CH4的混合气体0.3mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如右图所示。[投料比=
N2(g)+ CO2(g)+ 2H2O(g) ΔH,向容积为2L的恒容密闭容器中,充入NO2和CH4的混合气体0.3mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如右图所示。[投料比=![]() ] ;下列说法不正确的是
] ;下列说法不正确的是

A. ΔH < 0
B. X > 2
C. 400K时,反应的平衡常数为5×10-2
D. 投料比为2时,Q点v逆(CH4)小于P点的v逆(CH4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰基扁桃酰氯是一种医药中间体。 某研究小组以甲苯和乙醇为主要原料,按下列路线合成乙酰基扁桃酰氯。

已知:

(1)甲苯与氯气反应生成 A的条件是________。
(2)物质 B中含有的官能团是________。
(3)物质 D 的结构简式是_________。
(4)下列说法正确的是________。
a.化合物 A不能发生取代反应
b.乙酰基扁桃酰氯属于芳香烃
c.化合物 C 能与新制的 Cu(OH)2发生反应
(5)E+F→G 的化学方程式是_______。
(6)化合物 D 有多种同分异构体,同时符合下列条件的同分异构体共有_______ 种,写出其中两种的同分异构体的结构简式_______。
①红外光谱检测表明分子中含有氰基(-CN);
②1H-NMR 谱检测表明分子中有苯环,且苯环上有两种不同化学环境的氢原子。
(7)设计以乙醇为原料制备 F 的合成路线(用流程图表示;无机试剂任选) _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氢键,下列说法正确的是( )
A. 含氢元素的化合物中一定有氢键
B. 氢键比分子间作用力强,所以它属于化学键
C. DNA中的碱基互补配对是通过氢键来实现的
D. H2O是一种非常稳定的化合物,这是由于氢键所致
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的无机化工产品,合成氨工业对国民经济和社会发展具有重要的意义。其原理如下:N2(g)+3H2(g)![]() 2NH3 (g)ΔH<0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。
2NH3 (g)ΔH<0。在恒温恒容密闭容器中进行合成氨反应,各组分浓度与时间的关系如图所示。
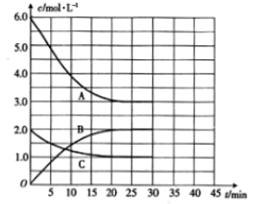
(1)表示N2浓度变化的曲线是___________(填字母),25min时c(NH3)=_________。
(2)0~25min内,用H2浓度变化表示的化学反应速率是_______________。
(3)此温度下,上述反应的平衡常数K的数值为_________________。
(4)若升高温度,则平衡向___________(填“正反应”或“逆反应”)方向移动;正反应速率_____(填“增大”“减小”或“不变”,下同),逆反应速率__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com