
【题目】浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不能显示的性质是( )
A.酸性
B.脱水性
C.强氧化性
D.吸水性
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁[(C6H11O7)2Fe2H2O]是重要的矿物质添加剂,它的吸收效果比无机铁盐好。一种工业上制备葡萄糖酸亚铁的工艺流程如下:
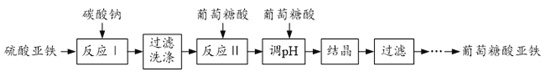
(1)反应Ⅰ的化学方程式为______。
(2)①碳酸亚铁过滤时需在表面保留水层的原因是______;
②检验FeCO3已经洗涤干净的操作为______。
(3)反应Ⅱ后加入葡萄糖酸调节溶液pH至5.8,其原因是______。
(4)葡萄糖酸亚铁溶液结晶、洗涤时均需加入乙醇,其目的分别是______,______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验装置和操作,回答有关问题。
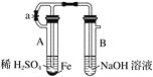
按图中所示装置,用两种不同的操作分别进行实验,观察B容器中的现象。
(1)先夹紧止水夹a,再使A容器中开始反应:①实验中B容器中观察到的现象是_________________;
②B容器中发生反应的离子方程式是____________________________________。
(2)打开止水夹a,使A容器开始反应一段时间后再夹紧止水夹a,①实验中观察到的现象是__________;②B容器中发生反应的离子方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是利用无土栽培法培养蔬菜时,培养液中元素的配方,其中根细胞吸收最少的是
离子 | K+ | M g2+ | Ca2+ | NO3- | H2PO4- | SO42- | Zn2+ |
培养液浓度(mol/L) | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
A. H2PO4-B. SO42-C. Ca2+D. Zn 2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由单质A与化合物B两种粉末组成的混合物,在一定条件下可按如图所示发生转化:
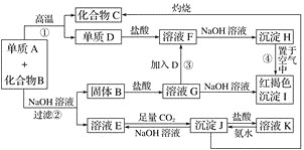
请回答:
(1)A、B的化学式分别为________、________。
(2)反应①的化学方程式:_____________________________________________________。
(3)写出反应②③的离子方程式:
②________________________________________________________________________;
③________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为_____________。
(2)前10 s内用M表示的化学反应速率为_____________。
(3)化学方程式中x值为_____________。
(4)在恒温恒容条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学设计实验,完成Cu和 Fe2(SO4)3溶液的反应,用 KSCN 溶液检验是否还存在 Fe3+。
实验 I:

已知: i. Cu2+![]() CuSCN↓(白色) + (SCN)2(黄色)
CuSCN↓(白色) + (SCN)2(黄色)
ii. (SCN)2的性质与卤素单质相似
iii. CuSCN溶于稀硝酸,发生反应 CuSCN+HNO3==CuSO4+N2+CO2+H2O(未配平)
(1) 依据现象i可预测该反应的离子方程式为__________________________。
(2) 该小组同学查阅资料认为现象ii中的白色沉淀可能为CuSCN,设计实验进行验证。
实验II: 取少量实验I中的白色沉淀于试管中_______________________,证明该白色沉淀为CuSCN。(补充所加试剂及实验现象)
(3)该小组同学继续探究白色沉淀的成因,进行如下实验,
实验III:
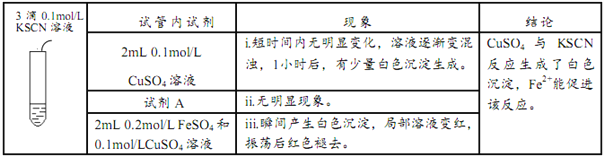
在实验III中:
①写出现象i中生成白色沉淀的离子方程式____________。
②试剂A为___________。
③根据现象iii结合化学用语及必要的文字解释Fe2+能加快沉淀生成的原因______。
(4)有的同学认为实验III不能充分证明其结论,并补充实验IV如下:
取2mL0.1 mol/L Fe2(SO4)3滴加3滴0.1mol/L KSCN溶液后,溶液变红,然后滴加2mL0.1mol/LCuSO4混合溶液于试管中, _____________________(现象)说明白色沉淀不是由Fe3+与SCN- 生成,且Fe3+不能加快CuSCN的生成。
(5)改变实验I铜的用量,设计实验V

该小组同学认为实验V中现象ii红色褪去与平衡移动有关,解释为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是有关金属与酸的反应,请填写下列空白:
(1)分别取W g钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是__________。
(2)分别取0.1 mol钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是_________。
(3)若产生相同物质的量的氢气,所需钠、铁、铝的质量比是___________________。
(4)若产生相同体积(同温同压)的氢气,所需钠、铁、铝的物质的量之比是_______________。
(5)分别取0.2 mol的金属钠、铁、铝分别投入10 mL 1 mol/L的盐酸中,标况下产生氢气的体积由大到小的顺序是______________。[钠、铁、铝产生氢气的体积分别用V1、V2、V3表示]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com