(2008?闵行区模拟)氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如下:

依据上图,完成下列问题:
(1)写出电解饱和食盐水的离子方程式:
.
(2)粗盐常含Ca
2+、Mg
2+、SO
42-等杂离子,精制过程中要将它们以沉淀的形式除去,则加入试剂的合理顺序为
BC
BC
(填编号).
A.先加入NaOH,后加入Na
2CO
3,再加入BaCl
2溶液
B.先加入NaOH,后加入BaCl
2溶液,再加入Na
2CO
3C.先加入BaCl
2溶液,后加入NaOH,再加入Na
2CO
3(3)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过
蒸发浓缩
蒸发浓缩
(填写操作名称)、冷却结晶、
过滤
过滤
(填写操作名称),除去NaCl.
(4)由图示可知在电解制碱过程中
NaCl
NaCl
可以循环使用,以提高反应物利用率;在制碱的同时,还产生H
2和Cl
2,工业上常常利用它们生产
盐酸(或HCl)
盐酸(或HCl)
.
(5)如图所示,目前电解法制烧碱通常采用离子交换膜法,阳离子交换膜不允许阴离子通过,阴离子交换膜不允许阳离子通过.
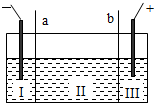
则以下叙述正确的是
AC
AC
(填编号).
A.NaOH、H
2均在Ⅰ区产生
B.图中a为阴离子交换膜,b为阳离子交换膜
C.Ⅲ区炭棒上的电极反应式为 2Cl
--2e→Cl
2↑
D.取少量Ⅲ区中的溶液,滴加酚酞,溶液变红色
(6)在实际生产中,经过脱盐后得到含溶质质量分数约为50%的NaOH溶液(密度为1.92g/cm
3),则该烧碱溶液的物质的量浓度为
24.0mol/L
24.0mol/L
.


 则以下叙述正确的是
则以下叙述正确的是

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案





 ;
;
