
【题目】以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
(2)用图中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 (填选项编号)。

(3)在实验流程中,加30%的H2O2溶液发生的离子反应方程式为 。
(4)验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 。
(5)若用调节pH溶液“沉铁”,则得到Fe(OH)3,已知:25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数为 。
Fe(OH)3+3H+的平衡常数为 。
(6)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3+ 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。

①集气瓶中收集到的气体是 (填化学式)。
②KMnO4溶液褪色,发生的离子反应方程式为 。
【答案】(1)Al2O3+ 3H2SO4= Al2(SO4)3+ 3H2O(2分)(2)B(1分)
(3)2Fe2++H2O2+2H+= 2Fe3++2H2O(2分)
(4)静置,溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含有铁元素,反之,则有。(其它合理答案)(2分)
(5)2.5×10-5(2分)
(6)①N2(1分)②2MnO4- +5SO2+2H2O=2Mn2++5SO42-+4H+(2分)
【解析】试题(1)铝灰中氧化铝与硫酸反应的化学方程式为Al2O3+ 3H2SO4= Al2(SO4)3+ 3H2O;
(2)FeO、Fe2O3和氧化铝溶于酸,二氧化硅不溶形成滤渣,二氧化硅和NaOH焙烧制备硅酸钠,不能用玻璃和瓷质容器,所以可采用的装置为B;
(3)过滤后滤液中存在Fe2+、Fe3+,Al3+,加30%的H2O2溶液会氧化Fe2+,离子反应方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)在被氧化后的溶液中加入了K4[Fe(CN)6]溶液把Fe3+沉淀,验证溶液中是否还含有铁离子的操作方法为静置,待溶液澄清后,继续向上层清液中滴加K4[Fe(CN)6]溶液,若无现象,则溶液中不含铁元素,反之则有;
(5)Ksp[Fe(OH)3]=4.0×10-38,即c(Fe3+)c3(OH-)=4.0×10-38,该温度下反应Fe3++3H2O![]() Fe(OH)3+3H+的平衡常数K=c3(H+)/c(Fe3+)=Kw3/c(Fe3+)c3(OH-)=(10-14)3/4.0×10-38=2.5×10-5;
Fe(OH)3+3H+的平衡常数K=c3(H+)/c(Fe3+)=Kw3/c(Fe3+)c3(OH-)=(10-14)3/4.0×10-38=2.5×10-5;
(6)①通过饱和亚硫酸氢钠溶液除去氨气、三氧化硫,通过高锰酸钾溶液除去二氧化硫气体,故收集的气体为N2;②KMnO4溶液与二氧化硫反应,离子反应方程式为2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+。


科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L-1 NaOH溶液滴定 20.00 mL 0.1000 mol·L-1 CH3COOH溶液,所得溶液的pH随加入NaOH溶液的体积变化如下图。下列说法正确的是

A.V(NaOH)=5 mL:c(Na+)=c(CH3COO-)
B.V(NaOH)=10 mL:c(Na+)<c(CH3COO-)
C.pH=7:c(Na+)>c(CH3COOH)+c(CH3COO-)
D.V(NaOH)=15 mL:3c(CH3COOH)+4c(H+)=c(CH3COO-)+4c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下,则下列判断正确的是( )
![]()
A.MFe2Ox是氧化剂
B.SO2是该反应的催化剂
C.x<y
D.MFe2Oy是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:

(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钠在医疗及食品方面有重要的作用。实验室用NaOH、单质碘和水合肼(N2H·H2O)为原料制备碘化钠。已知:水合肼具有还原性。回答下列问题:
(1)水合肼的制备有关反应原理为:CO(NH2)2(尿素)+NaClO+2NaOH![]() N2H4·H2O+NaCl+Na2CO3
N2H4·H2O+NaCl+Na2CO3
①制取次氯酸钠和氧氧化钠混合液的连接顺序为__________(按气流方向,用小写字母表示)。
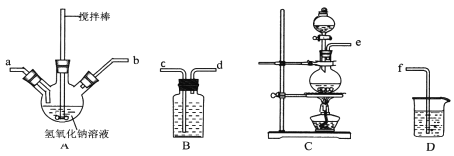
若该实验温度控制不当,反应后测得三颈瓶内ClO-与ClO3-的物质的量之比为5:1,则氯气与氢氧化钠反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为________。
②制备水合肼时,应将___________滴到 __________ 中(填“NaClO溶液”或“尿素溶液”),且滴加速度不能过快。
(2)碘化钠的制备采用水合肼还原法制取碘化钠固体,其制备流程如图所示:
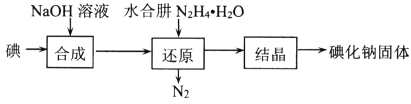
在“还原”过程中,主要消耗反应过程中生成的副产物IO3-,该过程的离子方程式为______________________________________。工业上也可以用硫化钠或铁屑还原碘酸钠制备碘化钠,但水合肼还原法制得的产品纯度更高,其原因是_________________________________。
(3)测定产品中NaI含量的实验步骤如下:
a.称取10.00g样品并溶解,在500mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入M溶液作指示剂:
c.用0.2100mol·L-1的Na2S2O3标准溶液滴定至终点(反应方程式为;2Na2S2O3+I2=Na2S4O6+2NaI),重复实验多次,测得消耗标准溶液的体积为15.00mL。
①M为____________(写名称)。
②该样品中NaI的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C的结构简式是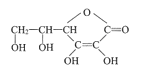 ,维生素C能防治坏血病。
,维生素C能防治坏血病。
(1)维生素C的分子式为_____________。
(2)维生素C中含氧官能团有酯基和_______________(填名称)。
(3)在维生素C溶液中滴入几滴紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有____性。
(4)维生素C具有还原性。向维生素C溶液中滴入几滴酸性KMnO4溶液,现象为_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做了如下实验:
装置 |
|
|
现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
下列说法中正确的是
A.加热铁片Ⅰ所在烧杯,电流表指针会发生偏转
B.用KSCN溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断电池的正、负极
C.铁片Ⅰ、Ⅲ的腐蚀速率相等
D.“电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+ 。将一定量的该磁黄铁矿与l00 mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成2.4 g硫单质、0. 425 mol FeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法不正确的是
A.该盐酸的物质的量浓度为8.5 mol/L
B.生成的H2S气体在标准状况下的体积为9.52 L
C.该磁黄铁矿FexS中,x=0. 85
D.该磁黄铁矿FexS中,Fe2+的物质的量为0. 15mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO42-与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图所示。下列说法正确的是( )

A. 正极的电极反应式为:2H2O+O2+4e-=4OH-
B. SO42-与H2的反应可表示为:4H2+SO42--8e S2-+4H2O
S2-+4H2O
C. 钢管腐蚀的直接产物中含有FeS、Fe(OH)2
D. 在钢管表面镀锌或铜可减缓钢管的腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com