
【题目】向80mL浓硫酸中加入56g铜片,加热一段时间后,至不再反应为止,计算:
(1)实验测得反应中共有13.44L标准状况下的SO2生成,被还原的硫酸的物质的量为_____mol,反应中转移的电子有_____mol。
(2)将反应后的混合物加水稀释到100mL并除去不溶物,加入足量锌粉放出标准状况下5.376L氢气,则原浓硫酸的物质的量浓度为_____,反应的Zn的质量为_____。
【答案】0.6 1.2 18mol/L 54.6g
【解析】
(1)Cu与浓硫酸反应方程式为Cu+2H2SO4![]() CuSO4+SO2↑+2H2O,H2SO4被还原成SO2,根据S原子守恒,被还原硫酸的物质的量n(H2SO4)=n(SO2)=13.44L/22.4L·mol-1=0.6mol,转移电子物质的量为0.6mol×2=1.2mol;
CuSO4+SO2↑+2H2O,H2SO4被还原成SO2,根据S原子守恒,被还原硫酸的物质的量n(H2SO4)=n(SO2)=13.44L/22.4L·mol-1=0.6mol,转移电子物质的量为0.6mol×2=1.2mol;
(2)加入足量的锌粉放出氢气,说明与铜反应的硫酸过量,过量硫酸与锌发生Zn+H2SO4=ZnSO4+H2↑,过量硫酸的物质的量n(H2SO4)=n(H2)=5.376L/22.4L·mol-1=0.24mol,根据(1)与铜反应硫酸的物质的量为n(H2SO4)=2n(SO2)=2×0.6mol=1.2mol,即原浓硫酸的物质的量为(1.2mol+0.24mol)=1.44mol,即c(H2SO4)=1.44mol/(80×10-3L)=18mol·L-1,Zn与反应后溶液发生:Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑,消耗Zn的物质的量为n(Zn)=n(CuSO4)+n(H2SO4)=n(SO2)+n(H2)=(0.6+0.24)mol=0.88mol,即消耗Zn的质量为0.84mol×65g·mol-1=54.6g。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】现有下列仪器或装置,请回答下列问题:
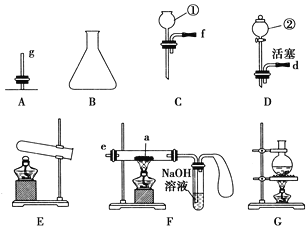
(1)仪器①的名称是________,②的名称是________。
(2)用上图仪器组装成气体发生装置:用KClO3和MnO2制O2应选的装置是________(填字母);用废H2O2与MnO2制O2,并控制产生O2的速率,应选________(填字母)。
(3)若用装置X进行“排空气法”收集制取的O2,氧气应从________(填“b”或“c”)端导入。若瓶中装满水,用排水法收集氧气,氧气应从________(填“b”或“c”)端导入。
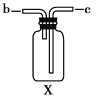
(4)若用F装置进行CO还原Fe2O3的实验,实验室制取CO的方法一般采取甲酸脱水法(HCOOH![]() CO↑+H2O),用纯净的CO完成该实验。
CO↑+H2O),用纯净的CO完成该实验。
①除F、X外还需要的装置有________,X中应加入的试剂是________,X与其它导管连接的顺序是________(填导管口的序号);
②实验时,a处的可能的现象为_________________;F装置中气球的作用是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.由Na2CO3 + SiO2 ![]() Na2SiO3 + CO2↑可知,酸性H2SiO3>H2CO3
Na2SiO3 + CO2↑可知,酸性H2SiO3>H2CO3
B.氢氟酸需要密封存放在橡胶塞的玻璃试剂瓶中
C.向硅酸钠溶液中加入盐酸产生白色沉淀,过量时沉淀溶解
D.瓷坩埚、氧化铝坩埚均不可作为融化NaOH固体的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实对应的离子方程式或电极反应式书写正确的是( )
A. 用石墨作电极电解CuSO4溶液2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
B. 碳酸钠溶液显碱性:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C. 钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D. 在强碱溶液中Fe(OH)3与NaClO反应生成Na2FeO4:3ClO-+2 Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法不正确的是( )
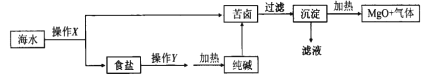
A. 操作X是蒸发、结晶、过滤、洗涤
B. 操作y是先将NH3通入饱和食盐水,再不断通入CO2
C. 沉淀主要成分为Mg(OH)2
D. 气体及滤液可用于制备纯碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)CO2的电子式是 ,所含化学键的类型是 。
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
①写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式 。
②一定条件下,上述合成二甲醚的的反应达到平衡状态后,若改变反应的某个条件,下列变化能说明平衡一定向正反应方向移动的是(只有一个选项符合题意) (填字母代号)。
a.逆反应速率先增大后减小
b.H2的转化率增大
c.CO2的体积百分含量减小
d.容器中c(H2)/c(CO2)的值减小
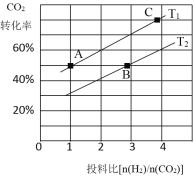
③在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如右图所示。T1温度下,将6 molCO2和12 molH2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5 min内的平均反应速率v(CH3OCH3)= ;KA、KB 、KC三者之间的大小关系为 。
(3)CO2溶于水形成H2CO3。已知常温下H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,NH3·H2O的电离平衡常数K=1.75×10-5。常温下,用氨水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液显 ;(填“酸性”、“中性”或“碱性”);请计算反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K= 。
NH3·H2O+H2CO3的平衡常数K= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-的物质的量浓度和Cl-的物质的量与50mL1mol/L的AlCl3溶液中Cl-物质的量浓度和Cl-的物质的量都相等的是
A. 75mL3mol/L的NH4Cl B. 150mL1mol/L的NaCl
C. 50mL1.5mol/L的CaCl2 D. 50mL3mol/L的NaClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某城市某日空气质量报告:
污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
55 | SO2 | II | 良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
实验一:用下图所示装置进行实验。
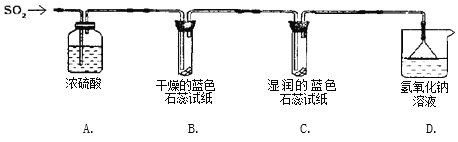
(1)A装置的作用是______________。
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成_____色,说明SO2与水反应生成一种酸。
(3)D装置的作用是_________ ,写出反应的化学方程式_____________________________。
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的pH_______7(填“>”“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气氧化最终成_______。
(查阅资料) SO2形成酸雨的另一途径:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作_____。
(探究结论)SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
(1)酸雨造成的危害是:______________________________。
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为____________,是造成酸雨的另一主要原因。
(提出建议)该市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加人_________(填“水”或“乙醇”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com