
| A. | 5.3g | B. | 10.6g | C. | 14.3g | D. | 16.4g |
分析 向足量的饱和碳酸钠溶液中加入无水碳酸钠粉未,析出晶体Na2CO3•10H2O,原饱和碳酸钠溶液水减少,也有碳酸钠晶体析出.
解答 解:5.3g无水Na2CO3的物质的量为$\frac{5.3g}{106g/mol}$=0.05mol,加入到饱和Na2CO3溶液中生成0.05molNa2CO3•10H2O结晶水合物,其质量为0.05mol×286g/mol=14.3g,
又原饱和溶液由于加入无水Na2CO3与水反应而消耗溶液中的水,会有晶体析出,故析出晶体的质量大于14.3g,
故选D.
点评 本题考查饱和溶液的计算问题,难度不大,注意析出晶体后剩余溶液仍为饱和溶液,析出晶体为结晶水合物.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯甲酸和苯甲酸钠都是食品防腐剂 | |
| B. | 食用花生油和汽油都属于酯 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 毛发、鸡蛋清都不能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
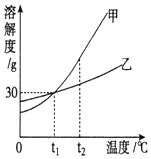 图是甲、乙两种固体物质的溶解度曲线.
图是甲、乙两种固体物质的溶解度曲线.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
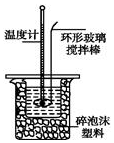 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 试验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
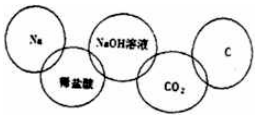 某同学在奥运五连环中填入5种物质 (如图所示),相连环的物质间发生的反应中,没有涉及的基本反应类型是( )
某同学在奥运五连环中填入5种物质 (如图所示),相连环的物质间发生的反应中,没有涉及的基本反应类型是( )| A. | 分解反应 | B. | 复分解反应 | C. | 化合反应 | D. | 置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅在自然界中既有游离态又有化合态 | |
| B. | 高温下SiO2能与Na2CO3固体反应生成Na2SiO3和CO2,说明硅酸酸性强于碳酸 | |
| C. | 因为玻璃中含有SiO2,所以不能用磨口玻璃塞的试剂瓶盛装碱性溶液 | |
| D. | SiO2能与氢氧化钠溶液和氢氟酸反应,所以SiO2是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
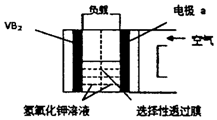 硼化钒(VB2)-空气电池是目前储电能力最高的电池(如图所示),电池总反应为:4VB2+11O2═4B2O3+2V2O5,下列叙述错误的是( )
硼化钒(VB2)-空气电池是目前储电能力最高的电池(如图所示),电池总反应为:4VB2+11O2═4B2O3+2V2O5,下列叙述错误的是( )| A. | 负极反应式为4VB2+44OH-═2V2O5+4B2O3+22H2O | |
| B. | 正极反应式为11O2+44e-+22H2O=44OH- | |
| C. | OH-由负极透过性选择性透过膜向正极迁移 | |
| D. | 电子由硼化钒电极负载流向电极a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com