
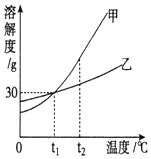
 图是甲、乙两种固体物质的溶解度曲线.
图是甲、乙两种固体物质的溶解度曲线.分析 (1)溶解度曲线的交点表示该温度下物质的溶解度相等;
(2)据t2℃时甲乙的溶解度大小分析解答;
(3)据甲的溶解度随温度变化情况及不饱和溶液、饱和溶液的转化方法分析解答;
(4)据甲、乙的溶解度随温度变化情况分析分离物质的方法.
解答 解:(1)溶解度曲线的交点表示该温度下物质的溶解度相等,t1℃时甲、乙两种物质的溶解度相等,
故答案为:t1;
(2)t2℃时甲的溶解度大于乙的溶解度相等,所以将等质量的甲、乙两种物质加水溶解配制成饱和溶液,需要水的质量甲小于乙,故所得溶液的质量是甲小于乙,故答案为:<;
(3)甲的溶解度随温度升高而增大,不饱和溶液变为饱和溶液的方法有增加溶质、蒸发溶剂、降低温度的方法;
A、若采取增加溶质、降温的方法,则溶剂的质量不变,故A错误;
B、若采取降温恰好饱和的方法,溶质的质量不变,采取增加溶质的方法,溶质质量增加,故溶质的质量可能不变,故B正确;
C、若采取降温恰好饱和的方法,则溶质的质量分数不变,故C错误;
D、若采取降温恰好饱和的方法,则溶液的质量不变,故D错误,
故答案为:B;
(4)甲的溶解度随温度的升高而增大,乙的溶解度受温度影响不大,故除去甲物质中少量乙物质可采取蒸发浓缩,降温结晶的方法,
故答案为:降温.
点评 本题考查了溶解度曲线的应用,及不饱和溶液和饱和溶液的相互转化,考查了学生分析解决问题的能力,题目难度中等.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CO18OC2H5+H2O $?_{△}^{稀硫酸}$ CH3COOH和C2H518OH | |
| B. | 溴乙烷与氢氧化溶液共热:CH3CH2Br+NaOH $→_{△}^{水}$ CH3CH2OH+NaBr | |
| C. | 蔗糖水解: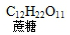 +H2O$\stackrel{催化剂}{→}$ +H2O$\stackrel{催化剂}{→}$ | |
| D. | 苯酚钠中通入二氧化碳: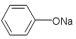 +CO2+H2O→ +CO2+H2O→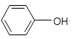 +NaHCO3 +NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
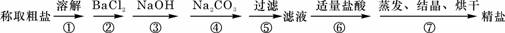
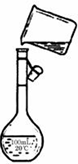 (5)为检验精盐纯度,需配制100mL 1mol/L NaCl溶液,右图是该同学转移溶液的示意图,图中的错误是未用玻璃棒引流
(5)为检验精盐纯度,需配制100mL 1mol/L NaCl溶液,右图是该同学转移溶液的示意图,图中的错误是未用玻璃棒引流查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn为电池的正极 | |
| B. | 负极反应式为2FeO42-+10H++6e-═Fe2O3+5H2O | |
| C. | 该电池使用完不可随便丢弃,应深埋地下 | |
| D. | 电池工作时OH-向负极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| 键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | amol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
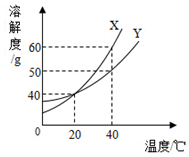 X、Y两种固体的溶解度曲线见图.
X、Y两种固体的溶解度曲线见图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不粘锅的原料 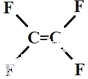 为烃类化合物 为烃类化合物 | |
| B. | 分子组成相差1个或若干个“CH2”原子团的有机物,互称为同系物 | |
| C. | 石油分馏是物理变化,煤的气化、液化是化学变化 | |
| D. | 聚乙烯塑料袋因有毒,不可以装食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.3g | B. | 10.6g | C. | 14.3g | D. | 16.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ |
| 1 | 25.0 | 32.6 | |
| 2 | 25.1 | 31.8 | |
| 3 | 25.1 | 31.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com