
下列叙述不正确的是
A.CaCO3能够溶解在CO2的水溶液中
B.Mg(OH)2可溶于盐酸,不溶于NH4Cl溶液
C.AgCl可溶于氨水
D.MgSO4溶液中滴加Ba(OH)2得到两种沉淀
B
【解析】对于溶解平衡,增大某种离子浓度可以促进沉淀生成。A项中CaCO3(s)  Ca2+(aq)+CO32-(aq),H2CO3
Ca2+(aq)+CO32-(aq),H2CO3 H++HCO3-,CO32-和H+结合生成HCO3-,促使两个平衡都向正向移动,CaCO3逐渐溶解转化为Ca(HCO3)2,A正确;Mg(OH)2(s)
H++HCO3-,CO32-和H+结合生成HCO3-,促使两个平衡都向正向移动,CaCO3逐渐溶解转化为Ca(HCO3)2,A正确;Mg(OH)2(s)  Mg2+(aq)+2OH-(aq),加入盐酸或NH4Cl溶液,均消耗OH-,促使Mg(OH)2溶解,B错;AgCl(s)
Mg2+(aq)+2OH-(aq),加入盐酸或NH4Cl溶液,均消耗OH-,促使Mg(OH)2溶解,B错;AgCl(s) Ag+(aq)+Cl-(aq),加入氨水后Ag++2NH3·H2O=2H2O+[Ag(NH3)2]+,所以AgCl逐渐溶解,C正确;Mg2++SO42-+Ba2++2OH-=Mg(OH)2↓+BaSO4↓,得到两种沉淀,D正确。答案选B。
Ag+(aq)+Cl-(aq),加入氨水后Ag++2NH3·H2O=2H2O+[Ag(NH3)2]+,所以AgCl逐渐溶解,C正确;Mg2++SO42-+Ba2++2OH-=Mg(OH)2↓+BaSO4↓,得到两种沉淀,D正确。答案选B。


科目:高中化学 来源:2014高考名师推荐化学元素周期律及化学键(解析版) 题型:选择题
短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质。而Z不能形成双原于分子。根据以上叙述,下列说法中正确的是
A.上述四种元素的原子半径大小为W < X < Y < Z
B.W、X、Y、Z原子的核外最外层电子数的总和为20
C.W与Y可形成既含极性共价键又含非极性共价键的化合物
D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学Vm与它的推论应用(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA
B.常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA
C.1 mol Al3+离子含有的核外电子数为3NA
D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学NA与粒子(解析版) 题型:选择题
某气体的摩尔质量为M g·mol-1,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为V L的该气体所含有的分子数为X。则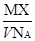 表示的是
表示的是
A.V L该气体的质量(以g为单位)
B.1 L该气体的质量(以g为单位)
C.1 mol该气体的体积(以L为单位)
D.1 L该气体中所含的分子数
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学Ksp的计算及有关图像的分析(解析版) 题型:填空题
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s)  2Ca2++2K++Mg2++4
2Ca2++2K++Mg2++4 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:

(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_________________________________________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入________溶液调滤液pH至中性。

(4)不同温度下,K+的浸出浓度与溶浸时间的关系如图。由图可得,随着温度升高,
①________________________________________________________,
②________________________________________________________。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+ ?
? CaCO3(s)+
CaCO3(s)+
已知298 K时,Ksp(CaCO3)=2.80×10-9,
Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学Ksp概念及简单应用(解析版) 题型:选择题
在25 ℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是
A.25 ℃时,CuS的溶解度大于ZnS的溶解度
B.25 ℃时,饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
C.向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学CB计算法(解析版) 题型:选择题
某混合溶液中所含离子的浓度如下表,则M离子可能为
所含离子 | NO | SO42- | H+ | M |
浓度(mol·L-1) | 2 | 1 | 2 | 1 |
A.Mg2+ B.Ba2+ C.F- D.Na+
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
对可逆反应N2(g)+3H2(g) 2NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是
2NH3(g),△H=-92.4 kJ·mol-1下列叙述正确的是
A.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
B.若单位时间内消耗x mol N2,同时生成2x mol NH3,则反应达到平衡状态
C.达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍
D.若达到平衡时,共放出46.2kJ热量,则有l mo1NH3(g)生成
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:选择题
锅炉水垢是一种安全隐患,除去水垢中的CaSO4,可先用Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,而后用酸除去。下列说法不正确的是:
A.CaCO3的溶解度小于CaSO4
B.沉淀转化的实质是沉淀溶解平衡的移动
C.沉淀转化的难易与溶解度差别的大小无关
D.CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com