
【题目】如下图所示,室温下的两个连通刚性容器用活塞分开,左右两室体积相同,左室充入一定量NO,右室充入一定量O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应且恢复至室温,反应如下:2NO+O2=2NO2。不考虑NO2转化为N2O4,下列判断正确的是
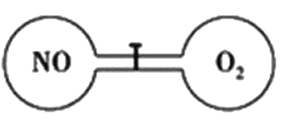
A. 反应前后左室的压强相同
B. 反应后容器内的密度与反应前的相同
C. 开始时左右两室中的分子数相同
D. 反应后容器内无O2存在
【答案】B
【解析】
A.发生2NO+O2=2NO2,反应后气体总物质的量减少,气体平均充满左右两室,则反应后NO室的气体物质的量也要减小,导致气体压强减小,选项A错误;
B.反应过程遵循质量守恒定律,反应后气体的总质量与反应前一氧化氮与氧气质量之和相等。由于容器的容积不变,气体的质量也不变,所以反应后容器内气体的密度与反应前气体的密度相同,选项B正确;
C.由左右两室体积相同,两容器内气体密度相同可知,两容器中气体的质量一定相等,而NO和O2的摩尔质量不相等,故二者的物质的量不相等,则开始时左右两室分子数不相同,选项C错误;
D.容器内NO、O2的质量相等,二者物质的量之比为32:30=16:15,两种气体发生反应:2NO+O2=2NO2,反应时二者的物质的量的比是2:1,可见O2过量,故最终容器内有O2存在,选项D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,现象和结论均正确的是
选项 | ① | ② | ③中现象 | 结论 | 装置图 |
A | 浓硝酸 | Cu | 淀粉-KI溶液变蓝 | NO2为氧化性气体 |
|
B | 稀硫酸 | Na2SO3 | 品红溶液褪色 | Na2SO3未变质 | |
C | 浓盐酸 | MnO2 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
D | 浓氨水 | NaOH | 湿润红色石蕊试纸变蓝 | NH3为碱性气体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K、1.01×105Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化合的热化学反应方程式正确的是

A. Se(s)+ H2(g) = H2Se(g) ΔH=-242kJ·mol-1
B. Se(s)+ H2(g) = H2Se(g) ΔH=-20kJ·mol-1
C. Se(g)+ H2(g) = H2Se(g) ΔH=+81kJ·mol-1
D. Se(s)+ H2(g) = H2Se(g) ΔH=+81kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 ②Na2CO3溶液和NaHCO3溶液都能跟盐酸反应 ③钠在常温下不容易被氧化 ④Na2O2可作供氧剂,而Na2O不行
A. 都正确 B. ②③④ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铝及其化合物的叙述正确的是( )
A. 铝粉与氧化铁在高温下可以发生铝热反应
B. 等量的铝分别与足量的盐酸和氢氧化钠溶液反应,产生的氢气体积不同
C. 工业上用电解熔融AlCl3的方法冶炼铝
D. 三氧化二铝是酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。
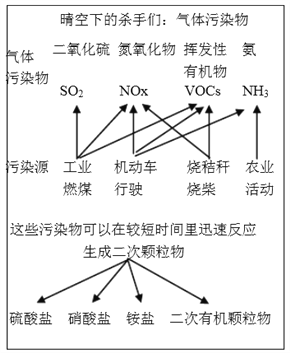
(1)根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_________,
a.SO2 b.NOx c.VOCs d. NH3
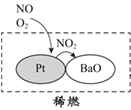
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______。
(3)SO2是气体污染物的主要成分之一。作为一种化学性质活泼的物质,它能发生多种反应,请按照下表提示,从不同角度梳理SO2不同类的化学性质,将化学方程式填在下表中。
SO2性质梳理 | 化学方程式 | |
物质类别 | 酸性氧化物 | ①SO2 +H2O |
②SO2 + CaO = CaSO3 | ||
③_______________________ | ||
S元素 价态 | S为+4价 | ①_______________________ |
② SO2 + 2H2S = 3S + 2H2O | ||
(4)科学家经过研究发现中国霾呈中性,其主要原因如图所示:
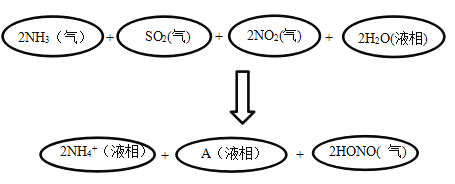
请判断A的化学式并说明判断理由:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室拟用如下装置进行SO2的制备及性质实验
①已知稀硝酸、亚硝酸作为氧化剂时,一般其还原产物为一氧化氮。
②lg2=0.3
③SO2易溶于水,通常条件下溶解的体积比为1∶40

回答下列问题:
(1)①制取SO2反应的化学方程式为_____________________________________________。
②实验开始时加入的5g CaCO3的作用是_____________________________________。
(2)①当__________________时,将NaHSO3晶体抖入烧瓶中,观察到D瓶及E瓶出现大量沉淀,
②写出D瓶中发生反应的离子方程式_____________________________________。
③(1)、(2)两步反应A中的导气管口的位置是_____________。
A.前“a”后“b” B.前“a”后“a” C.前“b”后“b” D.前“b”后“a”
(3)实验结果,B中仍澄清透明,C中稍有浑浊,通过手持技术检测B、C溶液中pH变化得到如下图象:

通过理论计算,若C中所有的NO3-被还原,所得溶液冲稀10倍后pH为_______(精确小数点后一位)
(4)结果分析,与实验方案评价SO2通入BaCl2溶液中与通入Ba(NO3)2溶液中pH 相差不大,若估测NO3-能将SO2氧化,理论计算值与实际测得值相差很大,分析其原因是同条件下:稀HNO3的氧化性_____ 稀 HNO2的氧化性(填“强于”或“弱于”或“接近”)。该实验设计在安全方面存在缺陷,请在不增加试剂瓶的前提下加以改进_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为__________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl | SO42- |
c/mol·L-1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____。
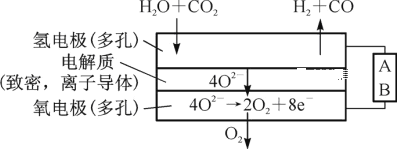
(2)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2—,O2—穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由图可知A为直流电源的____(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门等。下列性质与这些用途无关的是( )
A. 强度高 B. 不易生锈 C. 密度小 D. 导电、导热性好
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com