
【题目】甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为__________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl | SO42- |
c/mol·L-1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____。
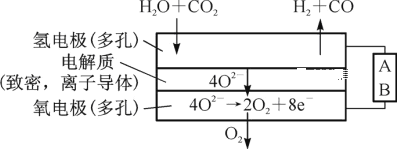
(2)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2—,O2—穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由图可知A为直流电源的____(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:________。
【答案】CH3OH-6e-+8OH-=CO32-+6H2O3.2g负极H2O+2e-=H2↑+O2-
【解析】
(1)①原电池中负极发生失去电子的氧化反应,则甲醇在负极通入,由于电解质溶液显碱性,则该电池负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O。
②石墨做电极,阳极首先是氯离子放电,然后是氢氧根离子放电,阴极首先是铜离子放电,然后是氢离子放电。溶液中铜离子、氢离子和氯离子的物质的量分别是0.1mol、0.4mol、0.4mol,由于两极收集到相同体积,这说明氢离子放电后继续电解水。设生成氧气的物质的量是x mol,则根据电子得失守恒可知0.1mol×2+(0.2+x)mol×2=0.4mol×1+x mol×4,解得x=0.1,所以阳极上收集到氧气的质量为0.1mol×32g/mol=3.2g。
(2)氧离子在阳极发生失去电子的氧化反应,阳极与电源的正极相连,则由图可知B是正极,因此A是负极。氢气在阴极生成同时产生氧离子,则以H2O为原料生成H2的电极反应式为H2O+2e-=H2↑+O2-。


科目:高中化学 来源: 题型:
【题目】下列各组物质中,X 表示某物质,Y 表示 X 物质中含有的少量杂质,Z 表示要除去杂质加入的试剂,其中正确的组别是

A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,室温下的两个连通刚性容器用活塞分开,左右两室体积相同,左室充入一定量NO,右室充入一定量O2,且恰好使两容器内气体密度相同。打开活塞,使NO与O2充分反应且恢复至室温,反应如下:2NO+O2=2NO2。不考虑NO2转化为N2O4,下列判断正确的是
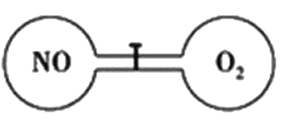
A. 反应前后左室的压强相同
B. 反应后容器内的密度与反应前的相同
C. 开始时左右两室中的分子数相同
D. 反应后容器内无O2存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学知识在生活中有重要意义,下列说法不正确的是( )
A. 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮氧化变质
B. 烧碱可以用于治疗胃酸过多
C. 计算机芯片所用的材料是高纯度的硅
D. 纯净的二氧化硅是生产光纤制品的基本原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A. 标准状况下,0.1moLCl2溶于水,转移的电子数目为0.1NA
B. 标准状况下,22.4 L H2O含有的分子数为NA
C. 1.8g D2O含有的电子数为0.1NA
D. 常温常压下,1.06 g Na2CO3含有的Na+数为0.02NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物D是重要的有机化工中间体,以丙烯为原料合成D的流程如下:

已知:
①在一定条件下,烯烃中α—H能与C12发生取代反应,生成氯代烯烃,但双键碳上的氢原子很难发生取代反应。
②
回答下列问题:
(1)B的结构简式为___________,B→C的反应类型是___________。
(2)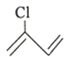 的名称为___________,该有机物分子中最多有___________个原子共平面。
的名称为___________,该有机物分子中最多有___________个原子共平面。
(3)反应C→D的化学方程式为______________________________________________。
(4)写出用1,3-丁二烯为原料制备化合物 的合成路线_________(其他试剂任选。提示:可利用1,3-丁二烯与Cl2的1,4-加成反应)。合成路线流程图示例:CH3CH2OH
的合成路线_________(其他试剂任选。提示:可利用1,3-丁二烯与Cl2的1,4-加成反应)。合成路线流程图示例:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() CH3CH2Cl。
CH3CH2Cl。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将500mL含有BaCl2和KCl的混合溶液分成10等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯高子完全沉淀。则该混合溶液中钾离子的浓度为
A. 20(b-2a)mol/L B. 20(b-a) mol/L
C. 0.2(b-2a) mol/L D. 20(2a-b)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,几种弱酸的电离平衡常数如下表所示,下列说法正确的是
化学式 | HCOOH | H2CO3 | HCN |
电离平衡常数 | K=1.8×10-4 | K1=4.3×10-7 K2=5.6×10-11 | K=4.9×10-10 |
A. 酸性强弱顺序是HCOOH>HCN> H2CO3
B. HCOOH的电离平衡常数表达式为
C. Na2CO3溶液显碱性,NaHCO3溶液显酸性
D. H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3+CN-=HCO3-+HCN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置和相应试剂能达到实验目的的是( )
选项 | 实验目的 | 试剂a | 试剂b | 试剂c | 装置 |
A | 验证非金属性:S>C>Si | 稀硫酸 | Na2CO3 | Na2SiO3溶液 |
|
B | 制备纯净的NO | 浓硝酸 | Cu | 水 | |
C | 检验溶液X中含有CO32- | 盐酸 | 溶液X | 澄清石灰水 | |
D | 除去Na2SO3中的Na2SO4 | 氯水 | 混合物 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com