
【题目】化学知识在生活中有重要意义,下列说法不正确的是( )
A. 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮氧化变质
B. 烧碱可以用于治疗胃酸过多
C. 计算机芯片所用的材料是高纯度的硅
D. 纯净的二氧化硅是生产光纤制品的基本原料
科目:高中化学 来源: 题型:
【题目】近日,中国科学家研发了一种碳修饰的镍基催化剂,实现了木质素选择性氢解得到酚类化合物。请回答下列问题:
(1)基态碳原子的核外电子有____种运动状态, 基态Ni原子的核外电子排布式为_________________。
(2)C、N、O三种元素的第一电离能由大到小的顺序为______________________。
(3)图1所示化合物中碳原子的杂化方式为_________,存在的化学键类型有_________(填标号)。

A.共价键 B.离子键 C.配位键 D.金属键 E.氢键
(4)碳的氧化物CO常作为许多金属配合物的配体,CO与N2互为等电子体,则CO分子中σ键与π键的个数比为______;测得熔点为170℃,预测属于___________晶体。
(5)一种储氢材料由镍、 镁元素组成,其晶胞结构如图2所示,则该晶体的化学式为__________,其晶胞边长为apm,列式计算晶胞密度为___________g/cm3 (不必计算出结果,阿伏加德岁常数的值为NA)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 ②Na2CO3溶液和NaHCO3溶液都能跟盐酸反应 ③钠在常温下不容易被氧化 ④Na2O2可作供氧剂,而Na2O不行
A. 都正确 B. ②③④ C. ②③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院官方微信于2017年3月发表《灰霾专题》,提出灰霾中细颗粒物的成因,部分分析如下图所示。
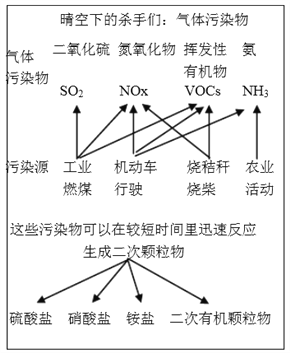
(1)根据上图信息可以看出,下列哪种气体污染物不是由机动车行驶造成的_________,
a.SO2 b.NOx c.VOCs d. NH3
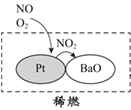
(2)机动车大量行驶是污染源之一。汽车发动机废气稀燃控制系统主要工作原理如图所示;写出稀燃过程中NO发生的主要反应的方程式_______。
(3)SO2是气体污染物的主要成分之一。作为一种化学性质活泼的物质,它能发生多种反应,请按照下表提示,从不同角度梳理SO2不同类的化学性质,将化学方程式填在下表中。
SO2性质梳理 | 化学方程式 | |
物质类别 | 酸性氧化物 | ①SO2 +H2O |
②SO2 + CaO = CaSO3 | ||
③_______________________ | ||
S元素 价态 | S为+4价 | ①_______________________ |
② SO2 + 2H2S = 3S + 2H2O | ||
(4)科学家经过研究发现中国霾呈中性,其主要原因如图所示:
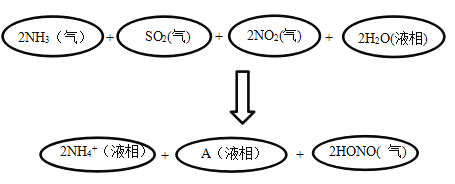
请判断A的化学式并说明判断理由:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室拟用如下装置进行SO2的制备及性质实验
①已知稀硝酸、亚硝酸作为氧化剂时,一般其还原产物为一氧化氮。
②lg2=0.3
③SO2易溶于水,通常条件下溶解的体积比为1∶40

回答下列问题:
(1)①制取SO2反应的化学方程式为_____________________________________________。
②实验开始时加入的5g CaCO3的作用是_____________________________________。
(2)①当__________________时,将NaHSO3晶体抖入烧瓶中,观察到D瓶及E瓶出现大量沉淀,
②写出D瓶中发生反应的离子方程式_____________________________________。
③(1)、(2)两步反应A中的导气管口的位置是_____________。
A.前“a”后“b” B.前“a”后“a” C.前“b”后“b” D.前“b”后“a”
(3)实验结果,B中仍澄清透明,C中稍有浑浊,通过手持技术检测B、C溶液中pH变化得到如下图象:

通过理论计算,若C中所有的NO3-被还原,所得溶液冲稀10倍后pH为_______(精确小数点后一位)
(4)结果分析,与实验方案评价SO2通入BaCl2溶液中与通入Ba(NO3)2溶液中pH 相差不大,若估测NO3-能将SO2氧化,理论计算值与实际测得值相差很大,分析其原因是同条件下:稀HNO3的氧化性_____ 稀 HNO2的氧化性(填“强于”或“弱于”或“接近”)。该实验设计在安全方面存在缺陷,请在不增加试剂瓶的前提下加以改进_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.元素周期表中有7个主族、7个副族
B.稀有气体元素原子的最外层电子数均为8
C.氢是原子半径最小的元素
D.硫元素位于第3周期ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
①该电池负极的电极反应式为__________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl | SO42- |
c/mol·L-1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____。
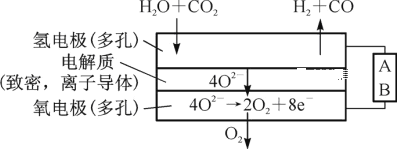
(2)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2—,O2—穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由图可知A为直流电源的____(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾是一种新型绿色氧化剂,制备高铁酸钾的工艺流程如下:

回答下列问题:
(1)步骤①中NaClO作______(填“氧化剂”“还原剂”或“催化剂”)。
(2)步骤②脱除的盐是______(填他学式)。
(3)步骤③是利用溶解度的不同进行的操作。则溶解度:Na2FeO4_____(填“>”或“<”)K2FeO4。
(4)本次实验中K2FeO4的产率为______。
(5)取少量K2FeO4于试管中,加硝酸酸化并堵住试管口,观察到溶液中有细微的小气泡产生,溶液紫色逐渐褪去,伸人一根带火星的木条,木条复燃;再向溶液中加入KSCN溶液,溶液变为血红色。则K2FeO4酸化时发生反应的离子方程式为_________;K2FeO4作为净水剂的优点除铁无毒外还有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一无色透明的溶液做如下实验:
(1)取少量溶液滴加盐酸酸化的BaCl2溶液,有白色沉淀生成。
(2)另取部分溶液加入Na2O2,有无色无味气体放出且有白色沉淀生成,加入Na2O2的量与生成沉淀的量的关系如图所示:
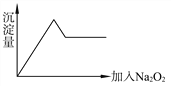
试问:
(1)Cu2+、NH4+、Al3+、Mg2+、Na+、Fe3+、CO32--、K+、SO42--等离子中一定存在的离子是_________________;可能存在的离子是_____________;一定不存在的离子是_____________________。
(2)上述溶液至少由___________________等物质混合成。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com