
����Ŀ��һ��ɫ������Һ������ʵ�飺
��1��ȡ������Һ�μ������ữ��BaCl2��Һ���а�ɫ�������ɡ�
��2����ȡ������Һ����Na2O2������ɫ��ζ����ų����а�ɫ�������ɣ�����Na2O2���������ɳ��������Ĺ�ϵ��ͼ��ʾ��
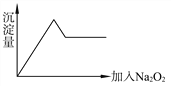
���ʣ�
��1��Cu2+��NH4����Al3+��Mg2+��Na+��Fe3+��CO32������K+��SO42������������һ�����ڵ�������_________________�����ܴ��ڵ�������_____________��һ�������ڵ�������_____________________��
��2��������Һ������___________________�����ʻ�ϳɡ�
���𰸡� Al3+��Mg2+��SO42�� Na+��K+ Cu2+��NH4�� ��Fe3+��CO32�� ����þ��������
��������(1)��������ɫ����Һ��������Һ�в��ܺ�����ɫ��Cu2+��Fe3+��������ȡ������Һ�μ������ữ��BaCl2��Һ�а�ɫ������������֪��Һ�к���SO42-������Һ�м���������ƣ�������ɫ��ζ���壬˵������Һ�в��� NH4+����Ϊ���� NH4+���������������ˮ��Ӧ���ɵ��������Ʒ�Ӧ���ɰ������������д̼�����ζ��������Һ�м����������ʱ�������ɰ�ɫ�������ҳ����������Ӻ���٣���������ȫ��ʧ��˵����Һ�к���Al3+��Mg2+����û��CO32-�����ڳ����ﵽ�������������Ĺ������ƺ���������ܽ⣬����Һ��һ��������NH4+����˸���Һ��һ�����ڵ�����Ϊ��SO42-��Al3+��Mg2+�����ܺ���Na+��K+��һ�������ڵ�����Ϊ��Cu2+��Fe3+��NH4+���ʴ�Ϊ��SO42-��Al3+��Mg2+��Na+��K+��Cu2+��Fe3+��NH4+��CO32-��
(2)��Һ��һ�����е�����ΪSO42-��Al3+��Mg2+���������ٴ��ڵ�����Ϊ��Al2(SO4)3��MgSO4���ʴ�Ϊ��Al2(SO4)3��MgSO4��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ڳ����£���(C6H6)Ϊһ����ɫ������Һ�壬���Խϸߣ��ӷ�����ȼ���и�ʴ�ԣ��е�Ϊ80.1����������ˮ���������л��ܼ�������Ϊ�л��ܼ�����(I2)Ϊ�Ϻ�ɫ���壬�����������������۵�113.5�����е�184.3��������ʱ������Ϊ��ɫ��������ȴ���������Ϻ�ɫ���塣ʵ���ҳ��ñ�����ȡ��ˮ�еĵ⣬����������£�
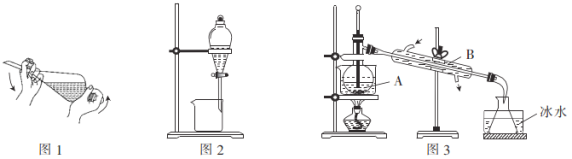
������ˮ��Һ�м�����ȡ������ת�Ƶ���Һ©���У����ϲ����������������(��ͼ1)��
������Һ©����������̨����Ȧ�Ͼ���(��ͼ2)��
������Һ©���е�Һ��ֳ�����������������ʵIJ�����������Һ����з��룻
����������ĵ�ͱ��Ļ��Һת�Ƶ�����A�У�����������ʯ���������Է��뱽�͵�(��ͼ3)��
��ش��������⣺
��1����Һ©����ʹ��ǰ������еIJ�����_______�����ú����е�ı���Һ�ڷ�Һ©����_____(�����ϲ��������²���)��
��2���������������ʵIJ�������������________��
��3���������в���ˮԡ���ȶ���ֱ�Ӽ��ȵ�ԭ����________________��ͼ3������A��������______��ͼ3���жദ���ԵĴ���a����ȴˮ�����������b��____________��C��___________��
��4����ƿ���ڱ�ˮ�е�Ŀ����____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪c��NH4Cl����0.1 mol/Lʱ����ҺpH��5.1������0.1 mol/L����ζ�10 mL 0.05 mol/L��ˮ���ü�����ָʾ�����ﵽ�ζ��յ㣬������������Ϊ
A. 10 mL B. 5 mL C. ����5 mL D. ��5 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����г��õ�ʵ�������У�����ֱ�����ڻ���������ᴿ���ǣ� ��
A.��Һ©��
B.��ͨ©��
C.������ƿ
D.����ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й����ʵ�ת����ϵ����ͼ��ʾ��������������������ȥ����A��B��C��D��F��Ϊ���壬����A����Է�������Ϊ16��F�ǻ���ɫ���ʣ�E�������Һ�壻X����ˮ����Ӧ���ǹ�ҵ�����е���Ҫ��Ӧ����Ӧ��������D�ļ��顣

��ش��������⣺
��1��C�ĵ���ʽΪ ��
��2��I�Ļ�ѧʽΪ ��
��3��д����Ӧ���Ļ�ѧ����ʽ�� ��
��4��д����Ӧ�������ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.5L 2mol/L FeCl3��Һ��0.2L 5mol/L KCl��Һ�е�Cl�����ʵ���֮�ȣ� ��
A.6��5
B.3��2
C.15��2
D.3��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�У����ڻ�ԭ��Ӧ����(����)
A. Cl-��Cl2 B. FeCl2��FeCl3
C. C��CO2 D. KMnO4��MnO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���绯ѧԭ���ڷ�ֹ������ʴ������ת�������ʺϳɵȷ���Ӧ�ù㷺��
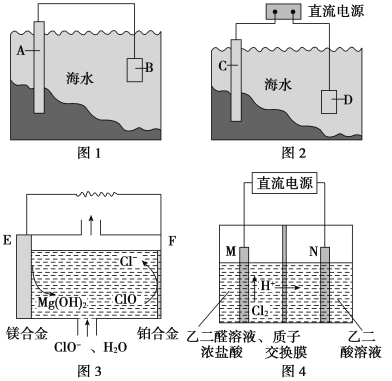
(1)ͼ1�У�Ϊ�˼�����ˮ�Ը�բ��A�ĸ�ʴ������B����ѡ��____________(����ĸ���)��
a��̼�� b��п�� c��ͭ��
�õ绯ѧԭ�����Ͳ���B�趨�ڲ�ԭ��_________________________��
(2)ͼ2�У���բ��C��____________�������Ȼ�����Һģ�⺣ˮ����ʵ�飬DΪʯī�飬��D�ϵĵ缫��ӦʽΪ____________�����õ缫��Ӧ����ķ�����___________________��
(3)þȼ�ϵ���ڿ��ƶ������豸��Դ�ͱ��õ�Դ�ȷ���Ӧ��ǰ��������ͼ3Ϊ��þ���������Ρ�ȼ�ϵ��ԭ��ʾ��ͼ���缫Ϊþ�Ͻ�Ͳ��Ͻ�
��EΪ��ȼ�ϵ�ص�__________��(���������)��F�缫�ϵĵ缫��ӦʽΪ________________________��
��þȼ�ϵ�ظ����������Ը�ʴ����������ʹ���������ʽ��ͣ��û�ѧ���������ԭ��_______________________��
(4)��ȩ��(HOOC��CHO)���л��ϳɵ���Ҫ�м��塣��ҵ���á�˫���ҳɶԵ�ⷨ��������ȩ�ᣬԭ����ͼ4��ʾ����װ��������������Ϊ���Ե缫�������Ҿ��ɲ�����ȩ�ᣬ�����Ҷ�ȩ��M�缫�IJ��ﷴӦ������ȩ�ᡣ
��N�缫�ϵĵ缫��ӦʽΪ____________________________��
������2 mol H��ͨ�����ӽ���Ĥ������ȫ�����˷�Ӧ�����װ�������ɵ���ȩ��Ϊ____________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼX��ֱ����Դ��Y����c��dΪʯī����Z����e��f��������ͬ��ͭ������ͨ��·����d�����Ժ�ɫ��
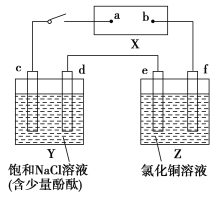
(1)����Դ��bΪ____________��(�á������������������������������)��
��Z����eΪ____________��(ͬ��)��
������Y��Z����·�У����������ķ�����d____________e(�á������������)��
(2)��д��c���Ϸ�Ӧ�ĵ缫��Ӧʽ��_______________________________��
��д��Y�����ܷ�Ӧ�Ļ�ѧ����ʽ��________________________________��
��д��Z����e���Ϸ�Ӧ�ĵ缫��Ӧʽ��_____________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com