
【题目】下列有关说法不正确的是 ( )
A. 铜合金有青铜,黄铜和白铜等
B. 合金具有优良的物理,化学或机械性能,但其熔点一般低于它的成分金属
C. 铝在纯氧气中能剧烈燃烧,火星四射,生成熔融的氧化铝
D. 生铁、普通钢和不锈钢中的含碳量依次降低
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】如果发现了原子序数为116的元素,下列叙述不正确是
①位于第七周期;
②是非金属元素;
③最外电子层含有6个电子;
④没有放射性;
⑤属于氧族元素;
⑥属于卤素。
A. ②④⑥ B. ①③⑥ C. ①③⑤ D. ②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碳和硅的叙述,正确的是
A. 其单质在加热时都能跟氧气反应
B. 其氧化物都能跟氢氧化钠溶液反应
C. 其含氧酸可由相应的氧化物溶于水得到
D. 其单质化学性质稳定,都能以游离态存在于自然界中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙是一种重要的化工原料,制备CaBr2·2H2O 的主要流程如下:
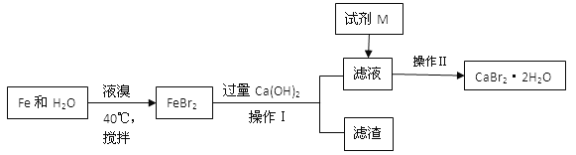
下列说法不正确的是
A. 试剂M 是HBr,加入HBr的目的是除去过量的Ca(OH)2
B. 操作I为过滤,滤渣为Fe、Fe(OH)2和Fe(OH)3;操作Ⅱ为重结晶,具体操作步骤为蒸发浓缩、冷却结晶、洗涤、干燥
C. 制得的CaBr2·2H2O 可以通过以下方法测定纯度:称取一定量的样品溶于水,滴入足量Na2CO3 溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却、称量,计算便得出CaBr2·2H2O的纯度
D. 工业上也可以将氨气通入石灰乳,并加入溴,于65℃进行反应,制得溴化钙,此反应中还会生成一种无色气体,该反应的化学方程式为3Ca(OH)2+3Br2+2NH3 ![]() 3CaBr2+N2+6H2O
3CaBr2+N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物既是一种资源,也会给环境造成危害。
I.氨气是一种重要的化工原料。
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)![]() (NH2)2CO(s)+H2O(g),ΔH= -x KJ/mol (x>0),其他相关数据如表:
(NH2)2CO(s)+H2O(g),ΔH= -x KJ/mol (x>0),其他相关数据如表:
物质 | NH3(g) | CO2(g) | CO(NH2)2(s) | H2O(g) |
1mol分子中的化学键断裂时需要吸收的能量/KJ | a | b | z | d |
则表中z(用x a b d表示)的大小为________。
(2)120℃时,在2L密闭反应容器中充入3mol CO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图所示,该反应到达平衡时CO2的平均反应速率为_____, 此温度时的平衡常数为_____。

下列能使正反应的化学反应速率加快的措施有___________.
① 及时分离出尿素 ② 升高温度 ③ 向密闭定容容器中再充入CO2 ④ 降低温度
Ⅱ.氮的氧化物会污染环境。目前,硝酸厂尾气治理可采用NH3与于NO在催化剂存在的条件下作用,将污染物转化为无污染的物质。某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体)。

(l)写出装置⑤中反应的化学方程式_________。
(2)装置①和装置②如下图,仪器A的名称为_____,其中盛放的药品名称为_______。

装置②中,先在试管中加入2-3 粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是________。
(3)装置⑥中,小段玻璃管的作用是______;装置⑦的作用是除去NO, NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W是合成某药物的中间体,其结构简式如下:
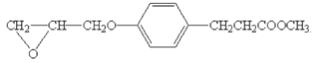
以有机物T为原料合成W的流程如图(部分条件省略):
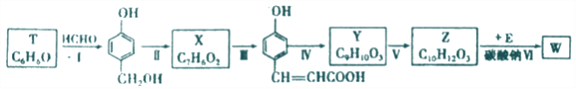
己知:RCH2ONa+CH3CH2X![]() RCH2OCH2CH3+NaX
RCH2OCH2CH3+NaX
请回答下列问题:
(1) Y中所含的官能团有_______.
(2)步骤Ⅵ中Na2CO3的作用为_______。
(3)请写出下列各步骤的反应类型:Ⅰ.__________;Ⅱ._________;Ⅴ.__________。
(4)利用步骤I的反应物,可制备某线型结构高分子,请写出相关化学反应方程式__________。
(5)物质X 最多可消耗H2______mol ,最终产物与足量HCOOH 完全反应的方程式为_______ 。
(6)写出同时满足下列条件的Y的所有同分异构体的结构简式:_______。
① 苯环上只有一个取代基
② 等量有机物分别与足量钠、足量碳酸氢钠溶液反应产生气体的物质的量相等
③ 在核磁共振氢谱图上有7个峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,天津连续出现了严重的雾霾天气,给人们的出行及身体造成了极大的危害。研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用钠碱循环法可脱除烟气中的SO2。
①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是___。
②吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显______性(填“酸”、“碱”或“中”),用化学平衡原理解释:__________。
③当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:

写出HSO3-在阳极放电的电极反应式:____________,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。
(2)用CH4催化还原NO2可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) =4NO(g) + CO2(g) + 2H2O(g); ΔH=-574 kJ mol-1
CH4(g) + 4NO(g) =2N2(g) + CO2(g) + 2H2O(g):ΔH=-1160 kJ mol-1
若用标准状况下4.48 L CH4还原 NO2至N2,整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为_________kJ。
(3)工业上合成氨所需氢气的制备过程中,其中的一步反应为:
CO(g) + H2O(g) ![]() CO2(g) + H2(g): ΔH<0
CO2(g) + H2(g): ΔH<0
—定条件下,将CO(g)与H2O(g)以体枳比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为丨:6,则平衡常数K=__________(计算结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关糖类、油脂、蛋白质的叙述正确的是
A. 油脂都不能使溴水褪色
B. 食物中含有的纤维素,可在人体内直接水解成葡萄糖
C. 糖类、油脂、蛋白质在一定条件下均可发生水解反应
D. 棉麻、蚕丝织品可通过灼烧时产生的气味来进行鉴别
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com