


科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、粗盐提纯时,为了加快过滤速率,可用玻璃棒搅拌过滤器中的液体 |
| B、用托盘天平称取10.5 g NaCl时应在右边托盘中放入10 g砝码 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、测定溶液pH的操作将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,然后与标准比色卡对照 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入足量的新制氯水,溶液颜色变深,则含有Br- |
| B、加入KMnO4酸性溶液,溶液颜色褪去,则含有Br- |
| C、加入少量的碘水,再加入CCl4振荡,CCl4层有色,则含有Br- |
| D、加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
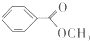 )是一种重要的工业有机溶剂.请分析下列有机物的结构简式或性质特点,然后回答问题.
)是一种重要的工业有机溶剂.请分析下列有机物的结构简式或性质特点,然后回答问题.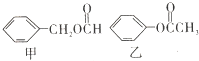
| 丙的分子式 | C7H8O |
| 丙的部分性质 | 熔融状态下能与钠反应放出氢气 |
| 遇FeCl3溶液显特殊紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、“氯碱工业”通过电解饱和食盐水生产氯气和烧碱 |
| B、通常状况下,干燥的氯气能和Fe反应 |
| C、纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状;光照H2和Cl2的混合气体时,因迅速化合而爆炸 |
| D、新制氯水具有漂白性,久置氯水最终变为稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、该反应的化学平衡常数表达式是K=
| ||
| B、此时,B的平衡转化率是35% | ||
| C、增大该体系的压强,平衡正向移动,化学平衡常数增大 | ||
| D、增加C,B的平衡转化率不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com