
【题目】磷烯(如图)是由磷原子六元环组成的蜂巢状褶皱二维晶体,它是白磷(![]() )的同素异形体。设NA为阿伏加德罗常数,下列说法正确的是
)的同素异形体。设NA为阿伏加德罗常数,下列说法正确的是

A.3.1g白磷中含P—P键的数目为0.3NA
B.6.2g磷烯中含六元环的数目为0.1NA
C.0.1molP4与0.6molH2在密闭容器中发生反应P4+6H2![]() 4PH3,生成PH3分子的数目为0.4NA
4PH3,生成PH3分子的数目为0.4NA
D.0.1molP4发生反应P4+5O2=2P2O5,转移的电子数为20NA
【答案】B
【解析】
A. 3.1g白磷的物质的量为![]() ,一分子白磷中含有6根P—P键,则3.1g白磷中P—P键的数目为0.025×6NA=0.15NA,故A错误;
,一分子白磷中含有6根P—P键,则3.1g白磷中P—P键的数目为0.025×6NA=0.15NA,故A错误;
B. 6.2g磷烯的物质的量为0.2mol,根据均摊法知,一个六元环含有P原子的数目为![]() ,则6.2g磷烯含六元环的数目为0.1NA,故B正确;
,则6.2g磷烯含六元环的数目为0.1NA,故B正确;
C. 该反应为可逆反应,不能完全进行到底,因此生成PH3分子的数目应小于0.4NA,故C错误;
D. P元素的化合价从0升高为+5价,O元素的化合价从0降低为-2价,则1molP4失电子数目为20NA,在氧化还原反应中,氧化剂得电子数=还原剂失电子数=转移电子数,则0.1molP4发生反应转移的电子数为2NA,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】氧气、二氧化碳是最常见的气体。回答下列问题:
(1)宇航员呼吸产生的CO2用下列反应处理,实现空间站中的O2循环利用。镍催化剂反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
①已知H2(g)+![]() O2(g)
O2(g)![]() H2O(g)ΔH=-akJ·mol-1,
H2O(g)ΔH=-akJ·mol-1,
CH4(g)+2O2(g)![]() CO2(g)+2H2O(g)ΔH=-bkJ·mol-1。则镍催化剂反应的ΔH=____kJ·mol-1
CO2(g)+2H2O(g)ΔH=-bkJ·mol-1。则镍催化剂反应的ΔH=____kJ·mol-1
②空间站中所涉及的反应有:
a.镍催化剂反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
b.电解水反应:2H2O(l)=2H2(g)+O2(g)
c.模拟呼吸反应:C(s)+O2(g)=CO2(g)
则实现空间站O2循环总反应为____
(2)可用O2将HCl转化为Cl2,实现循环利用:O2(g)+4HCl(g)![]() 2Cl2(g)+2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g)+2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。

③该反应的速率v=kca(O2)·cb(HCl),k为速率常数),下列说法正确的是____(填标号)。
A.温度升高,k增大
B.使用催化剂,k不变
C.在容器中充入不反应的He,总压增大,k增大
D.平衡后再充入1molO2和4molHCl,k增大
④T1____T2(填“>”或“<”);T1时的转化率____T2时的转化率(填“>”“=”或“<”)。
⑤T1时,HCl的平衡转化率=____;T2反应的Kx=____(Kx为以物质的量分数表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淡黄色固体A和气体X存在如下转化关系:请回答下列问题:

(1)固体A的名称___。
(2)将39克固体A投入到69克水中完全反应产生的气体在标准状况下的体积为多少毫升___?所得溶液的质量分数是多少___?(要求写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种温和的氧化剂,常温下为白色的固体,无臭无味,能潮解,难溶于水,可与水缓慢反应;不溶于醇类、乙醚等,易与酸反应,常用作杀菌剂、防腐剂等。某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙。

(1)请选择必要的装置,按气流方向连接顺序为_____(填仪器接口的字母编号,装置可重复使用)。
实验步骤如下:
①检验装置的气密性后,装入药品;
②打开分液漏斗活塞通入一段时间气体,加热药品;
③反应结束后,熄灭酒精灯,待反应管冷却至室温,停止通入氧气,并关闭分液漏斗的活塞;
④拆除装置,取出产物。
(2)一小组同学利用CaCl2在碱性条件下与H2O2反应制得。制备CaO2的实验方案和装置示意图如下:
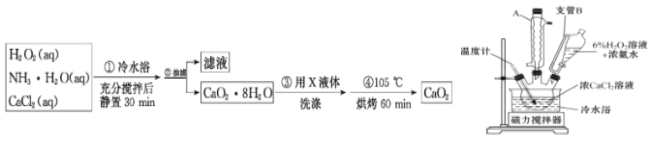
①三颈烧瓶中发生的主要反应的化学方程式为______________________________。
②支管B的作用是_____。
③步骤③中洗涤CaO2·8H2O的液体X 的最佳选择是_____;
A.无水乙醇 B.浓盐酸 C.水 D.CaCl2溶液
④该反应常用冰水浴控制温度在0℃左右,其可能的原因该反应是放热反应,温度低有利于提高CaO2·8H2O产率;_____。
(3)测定产品中CaO2 含量的实验步骤如下:
步骤一:准确称取a g 产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI 晶体,再滴入少量2 mol·L-1的硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴_____(作指示剂)。
步骤三:逐滴加入浓度为 c mol·L-1 的 Na2S2O3 溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3 溶液的体积为V mL。CaO2的质量分数为 _________(用字母表示)。(已知:I2+ 2S2O32-=2I-+ S4O62-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种矿石,经测定含有镁、硅、氧三种元素且它们的质量比为12∶7∶16。
(1)用盐的组成表示其化学式: ___________。
(2)用氧化物的组成表示其化学式: _______。
(3)该矿石的成分属于________(填物质的分类)。
(4)写出该矿石(氧化物形式)与盐酸反应的化学方程式: ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型冠状病毒来势汹汹,但是它依然可防可控。84消毒液具有强氧化性,可将冠状病毒外的包膜破坏后使RNA被降解,使病毒失活,以达到灭菌的效果。制取84消毒液的氯气可用加热浓盐酸和MnO2混合物来制取,也可用浓盐酸和KClO3直接混合来制取。回答下列问题:
(1)在周期表中与Mn相邻且未成对电子数最多的原子的价电子排布式为:___。
(2)K和O第一电离能I1(K)___I1(O)(填“大于”或“小于”)。原因是___。
(3)浓盐酸为HCl的水溶液,HCl极易溶于水的原因___,HCl和H2O中沸点较高的是___,其原因是___。
(4)KClO3晶体中,阴离子的空间构型为___,Cl的杂化轨道与O的2p轨道形成___键。
(5)金属K晶体为体心立方堆积,K原子半径为rpm,摩尔质量为Mg·mol-1,阿伏加德罗常数为NA,则晶体密度为___g﹒cm-3。(列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近代化学工业的基础是“三酸两碱”,早在我国古代就已经有人通过煅烧绿矾并将产生的气体溶于水中的方法制得硫酸,该法制备硫酸的过程中发生的主要反应如下:
反应Ⅰ:2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O↑;
反应Ⅱ:SO3+H2O=H2SO4。
下列说法正确的是
A.当生成标准状况下气体22.4L时,转移1mol电子
B.6.4gSO2中所含的质子数与6.4gSO3中所含的质子数相等
C.SO2、SO3的中心原子杂化类型不同
D.目前,工业上制硫酸的吸收阶段是采用浓硫酸吸收SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ是NO2(g)+CO(g)![]() CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态,当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态,当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
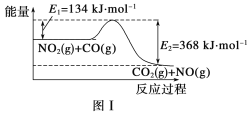

下列有关说法正确的是( )
A.一定条件下,向密闭容器中加入1molNO2(g)与1molCO(g)反应放出234kJ热量
B.若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C.若X表示温度,则Y表示的可能是CO2的物质的量浓度
D.若X表示反应时间,则Y表示的可能是混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.将铜丝插入稀硝酸中:Cu+4H++2![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
B.漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.硫酸铜溶液与过量的氨水反应:Cu2++4NH3H2O=[Cu(NH3)4]2++4H2O
D.用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com