
| A、0.4% | B、0.8% |
| C、2% | D、4% |
| 0.224L |
| 22.4L |
| 0.112L |
| 22.4L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单离子中半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 现象或事实 | 解释 |
| A | 明矾用于净水 | 铝离子水解产生的胶体具有很强吸附杂质的作用 |
| B | SO2能使溴水溶液褪色 | SO2具有还原性 |
| C | “地沟油”禁止食用,但可以用来制造肥皂 | “地沟油”主要成分为油脂属于酯类可以发生皂化反应 |
| D | 用氯水和淀粉溶液鉴别食盐是否加碘 | 目前加碘食盐中含碘元素物质为KI |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 化学式 | 键长/nm | 键角 | 沸点/℃ |
| H2S | 1.34 | 92.3° | -60.75 |
| H2Se | 1.47 | 91.0° | -41.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
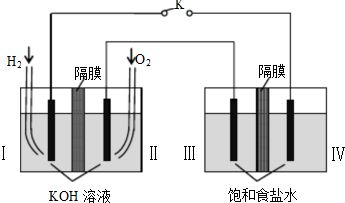
| A、电子流动方向:电极Ⅳ-Ⅰ |
| B、电极Ⅱ电极反应式:O2+2H2O+4e-=4OH- |
| C、电极Ⅲ发生还原反应 |
| D、电极Ⅳ附近观察到黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 乙酸 | 乙醇 | 正丁醇 | 乙酸乙酯 | 乙酸正丁酯 |
| 沸点(0C) | 117.9 | 78.5 | 117.7 | 77 | 126 |
| A、均采用水浴加热 |
| B、制备乙酸正丁酯时正丁醇过量 |
| C、均采用边反应边蒸馏的方法 |
| D、制备乙酸乙酯时乙醇过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com