
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单离子中半径最小 |
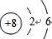 ,故答案为:
,故答案为: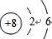 ;
;

 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
A、 装置,过滤海带灰浸取液 装置,过滤海带灰浸取液 |
B、 装置,在滤液中通入Cl2 装置,在滤液中通入Cl2 |
C、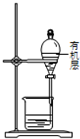 装置,先放出下层液体,再从下口放出有机层 装置,先放出下层液体,再从下口放出有机层 |
D、 装置,回收萃取剂苯并获得单质碘 装置,回收萃取剂苯并获得单质碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| CuCl | - 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4% | B、0.8% |
| C、2% | D、4% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com