

| 1 |
| 3 |
| 1 |
| 3 |
 ,分子中存在极性键和非极性键,故答案为:极性键和非极性键;
,分子中存在极性键和非极性键,故答案为:极性键和非极性键; ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、负极发生的反应为:Fe-2e-═Fe2+ |
| B、该电化学腐蚀过程为析氢腐蚀 |
| C、原电池是将电能转变为化学能的装置 |
| D、钢柱在水下部分比在空气与水交界处更容易腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
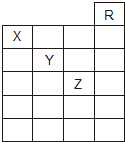 如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是( )| A、只有③ | B、只有①④ |
| C、只有①②③④ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素A | 元素B | 元素C | 元素X | 元素Y |
| 单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物 | 基态原子M层p轨道上有5个电子 | 短周期中金属性最强,与X反应能生成两种常见化合物 | 最外层电子数是内层电子数的3倍,能形成双原子阴离子 | 单质为双原子分子,结构中σ键与π数目比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的简单离子中半径最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com