


 ,故答案为:
,故答案为: ;
;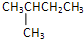 ;
;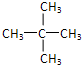 ;
; ,
, ;
; 该有机物为烷烃,分子中最长碳链含有5个C,主链为戊烷,编号从两端都可以,在3号C含有1个甲基,该有机物命名为:3-甲基戊烷;
该有机物为烷烃,分子中最长碳链含有5个C,主链为戊烷,编号从两端都可以,在3号C含有1个甲基,该有机物命名为:3-甲基戊烷; 该有机物为烷烃,分子中最长碳链含有5个C,主链为戊烷,编号从左端开始,在2号C、3号碳上都含有1个甲基,该有机物命名为:2,3-二甲基戊烷;
该有机物为烷烃,分子中最长碳链含有5个C,主链为戊烷,编号从左端开始,在2号C、3号碳上都含有1个甲基,该有机物命名为:2,3-二甲基戊烷;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、鸡蛋清溶液中加入饱和(NH4)2SO4溶液生成白色沉淀,属于物理变化 |
| B、纳米材料微粒直径一般从几纳米到几十纳米(1nm=10-9m),因此纳米材料属于胶体 |
| C、往Fe(OH)3胶体中逐滴加入稀硫酸会产生沉淀而后沉淀逐渐溶解 |
| D、水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com