
| c(CO)?c(H2) |
| c(H2O) |
| 0.03 |
| t2-t1 |
| 0.03 |
| t2-t1 |
| [H2]4 |
| [H2O]4 |


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
| A、简单离子半径大小顺序:r(T)<r(X)<r(Y) |
| B、T与Z的最高正化合价相等 |
| C、室温下,单质Y不能与浓硫酸反应 |
| D、可用电解法制得X、Y、Z的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
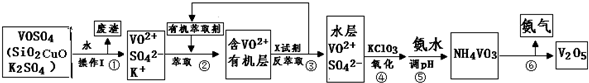
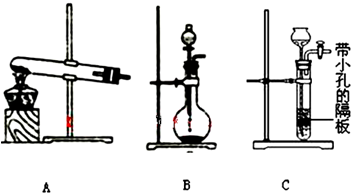
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为① |
| 乙小组 | ② |
浓氨水、氢氧化钠固体 | 分析产生氨气的原因③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com