
第三周期主族元素R,它的原子最外电子层上达到饱和所需电子数小于次外层和最内层电子数之差,但等于最内层电子数的正整数倍。下列说法正确的是( )
| A.常温下,能稳定存在的R的氧化物都能与烧碱溶液反应 |
| B.在常温下,R的气态氢化物都能在空气中稳定存在 |
| C.在固态时,R的单质都不与NaOH溶液反应 |
| D.R的最高价氧化物对应的水化物都是强酸 |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:单选题
不能用于判断金属失电子能力强弱的是
| A.同主族金属元素原子半径大小 |
| B.1 mol金属单质在反应中失去电子的多少 |
| C.水溶液中金属间发生的置换反应 |
| D.金属元素最高价氧化物对应水化物的碱性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法不正确的是
| A.原子半径的大小顺序:r(W)>r(Y)>r(Z)>r(X) |
| B.元素Z、W 的简单离子的电子层结构相同 |
| C.元素Y 的简单气态氢化物的热稳定性比Z 的强 |
| D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
类推是一种重要的学习方法,但如果不具体问题具体分析就会得出错误结论。下列类推结论正确的是
| A.SiH4的熔沸点比CH4高,则PH3的熔沸点比NH3高 |
| B.钠在空气中燃烧生成过氧化钠,则锂在空气中燃烧生成过氧化锂 |
| C.Al(OH)3能溶于NaOH溶液,则Be(OH)2能溶于NaOH溶液 |
| D.甲酸甲酯能发生银镜反应,则乙酸甲酯能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
同位素2H、15N、18O、34S等常被用作陆地生态分析研究。下列说法中正确的是( )
| A.16O和18O是同一种核素 |
| B.1H218O的摩尔质量为20 |
| C.34S和15N核内的中子数相差9 |
| D.2H+核外电子数为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )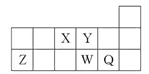
| A.元素X与元素Z的最高正化合价之和的数值等于8 |
| B.原子半径的大小顺序为:r(X)>r(Y)>r(Z)>r(W)>r(Q) |
| C.离子Y2-和Z3+的核外电子数和电子层数都不相同 |
| D.元素W的最高价氧化物对应的水化物的酸性比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲是周期表中原子半径最小的元素,乙形成的气态氢化物的水溶液呈碱性,乙与丁同族,丙、丁、戊同周期,丙单质可制成半导体材料,戊的最高化合价为+7,则 ( )。
| A.原子半径:乙>丁>丙 |
| B.非金属性:丙>丁>戊 |
| C.甲与戊形成的化合物是共价化合物 |
| D.乙、丙、丁最高价氧化物对应的水化物均是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、W、M五种元素的原子序数依次增大。已知X、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的阴离子核外电子排布与氦原子相同,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍,M是地壳中含量最高的金属元素。下列说法中正确的是( )
| A.五种元素的原子半径从大到小的顺序是:M>W>Z>Y>X |
| B.化合物X2W2、YW2、ZW2等都含有极性共价键和非极性共价键 |
| C.用M单质作阳极,石墨电极作阴极电解NaHCO3溶液,电解一段时间后,在阴极区会出现白色沉淀 |
| D.X、Z两元素能形成原子个数比为3∶1和4∶2的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z是位于不同周期的三种短周期元素,且原子序数逐渐增大,X、Z位于同一主族,三种元素可以形成原子个数比为1∶1∶1的化合物W。下列推测正确的是 ( )。
| A.元素Z的氧化物一定属于碱性氧化物 |
| B.原子半径:X<Y<Z |
| C.三种元素中,Y的金属性最强 |
| D.Y、Z都能形成含氧酸,且前者的酸性比后者强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com