
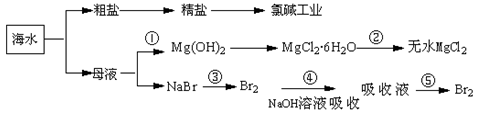
| A.氯碱工业中采用阳离子交换膜电解槽,可以防止氯气与碱的反应 |
| B.第②步中结晶出的MgCl2·6H2O不能采用直接在空气中受热分解制无水MgCl2 |
| C.第①步常采用往母液中加浓NaOH溶液来获取Mg(OH)2 |
| D.从第③步到第⑤步的目的是获得含溴单质浓度较高的溶液 |
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
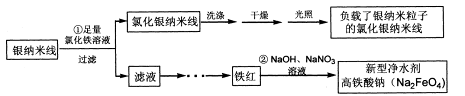
科目:高中化学 来源:不详 题型:填空题
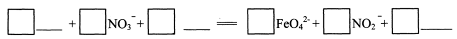
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.通常用石油的年产量来衡量一个国家的石油化学工业发展水平 |
| B.酸雨的形成主要是汽车排出大量尾气 |
| C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 |
| D.二氧化碳在我国重点城市近年来已发布的“空气质量日报”中不列入首要污染物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
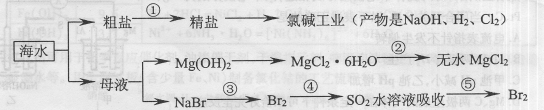
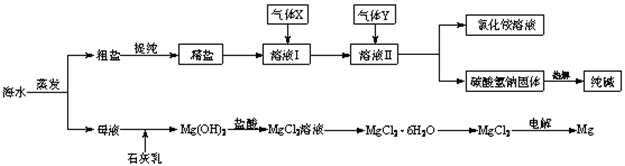
| A.在工段③和⑤中需要用到氯碱工业的产物 |
| B.工段②中的MgCl2·6H2O可在空气中受热分解制无水MgCl2 |
| C.大量的含Fe3+废水排人海洋,易引发赤潮 |
| D.工段①中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液一过滤后加盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
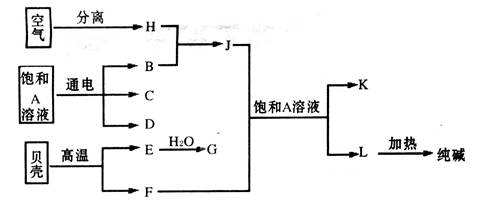

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
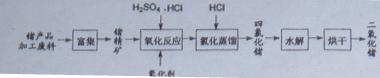
 2O2反应生成Ge4+,写出该反应的离子方程式 。
2O2反应生成Ge4+,写出该反应的离子方程式 。 (2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是 。实验室蒸馏操作时常用的玻璃仪器有:酒精灯、蒸馏烧瓶、 、 、接收管、锥形瓶等。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是 。实验室蒸馏操作时常用的玻璃仪器有:酒精灯、蒸馏烧瓶、 、 、接收管、锥形瓶等。 。
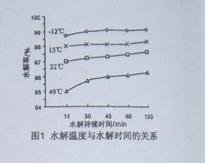
。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com