
 ��I���о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����壮��CO2�뽹̿��������CO��CO�����������ȣ�
��I���о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����壮��CO2�뽹̿��������CO��CO�����������ȣ����� ����1����֪��a��Fe2O3��s��+3C��ʯī��=2Fe��s��+3CO��g����H1=+489.0kJ•mol-1
b��C��ʯī��+CO2��g��=2CO��g����H2=+172kJ•mol-1
���ݸ�˹����a-b��3�õ�����õ��Ȼ�ѧ����ʽ��
��2��CO-O2ȼ�ϵ�أ���H2SO4��ҺΪ���Һ��������ԭ���ԭ��������ʧ���ӷ���������Ӧ��ȼ���ڸ���ʧ���ӷ���������Ӧ��
����1��Cu+H2SO4=H2��+CuSO4�����Է����У�Ҫ�Ǹ÷�Ӧ���������װ�ñ����ǵ��أ�
��2����ʯī���缫��ⱥ���Ȼ�����Һʱ�������������ӷŵ硢�����������ӷŵ磬ͬʱ�����������������������ɣ���������������������֮��Ĺ�ϵ��������������Ũ�ȣ��Ӷ�������Һ��pH��
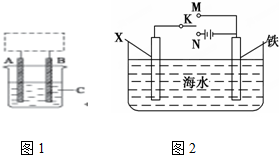
������ԭ�����������������Ľ�������������ZΪп������K����M�����÷���Ϊ����������������������
��� �⣺����1����֪��a��Fe2O3��s��+3C��ʯī��=2Fe��s��+3CO��g����H1=+489.0kJ•mol-1
b��C��ʯī��+CO2��g��=2CO��g����H2=+172kJ•mol-1
���ݸ�˹����a-b��3�õ���Fe2O3��s��+3CO��g���T2Fe ��s��+3CO2��g����H=489-172��3=-27KJ/mol��
�ʴ�Ϊ��-27KJ/mol��
��2��CO-O2ȼ�ϵ�أ���H2SO4��ҺΪ���Һ����һ����̼�ڸ���ʧ���ӷ���������Ӧ���ɶ�����̼��ԭ��ظ����缫��ӦΪ��CO+H2O-2e-=CO2+2H+�������缫��ӦΪ�����õ����ӷ�����ԭ��Ӧ����������Һ�еĵ缫��ӦΪ��O2+4H++4e-=2H2O��
�ʴ�Ϊ��CO+H2O-2e-=CO2+2H+��O2+4H++4e-=2H2O��
����1��Cu+H2SO4=H2��+CuSO4�����Է����У�Ҫ�Ǹ÷�Ӧ���������װ�ñ����ǵ��أ���Cu���������ʴ�Ϊ�����أ�
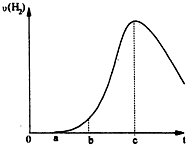
��2����ʯī���缫��ⱥ���Ȼ�����Һʱ�������������ӷŵ����������������������ӷŵ�����������ͬʱ�����������������������ɣ���ط�ӦʽΪ2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$H2��+Cl2��+2OH-��
���������������ӵ����ʵ���Ϊx��
2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$H2��+Cl2��+2OH-��
22.4L 2mol
0.112L x
22.4L��2mol=0.112L��x��
x=$\frac{0.112L��2mol}{22.4L}$=0.01mol��
c��OH-��=$\frac{0.01mol}{0.1L}$=0.1mol/L������Һ��pH=13��
�ʴ�Ϊ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2OH_+H2��+Cl2����13��
������XΪͭ��Ϊ�������ĸ�ʴ������ͭ���ã�����Ҫ������ӵ���������������������Ϊ�ӻ�����ʴ��KӦ����N����
��ZΪп������K����M�����÷���Ϊ����������������������
�ʴ�Ϊ��N������������������������
���� ���⿼���˸�˹���ɵ�Ӧ���Լ�ԭ��غ͵���ԭ�����ѵ��ǵ缫��Ӧʽ����д��pH�ļ��㣬Ҫ��ϵ������Һ���������д�缫��Ӧ����ϻ�ѧ����ʽ������ϵ��������������Ũ�ȣ���Ŀ�Ѷ��еȣ�


 Ӧ������ҵ��ϵ�д�
Ӧ������ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼������ȷֽ� | B�� | ��Ȼ����ȼ�� | ||
| C�� | ������ϡ���ᷴӦ | D�� | ��ʯ�ұ����ʯ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��Ҫ������������⣺
��Ҫ������������⣺
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
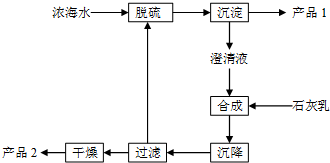 ����ˮ������ʣ���Ũ��ˮ��ͨ��һϵ�й������̿�������������Ʒ��
����ˮ������ʣ���Ũ��ˮ��ͨ��һϵ�й������̿�������������Ʒ�� _��
_��| ���� | Na+ | Mg2+ | Cl- | SO42- |
| Ũ��/��g•L-1�� | 63.7 | 28.8 | 144.6 | 46.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��FeCl3��Һ��ʴӡˢ��·�壺Fe3++Cu�TFe2++Cu2+ | |
| B�� | ������������Һ�м�������Һ��Ba2++SO42-�TBaSO4�� | |
| C�� | ����ˮ�ķ�Ӧ��2Na+2H2O�T2Na++2OH-+H2�� | |
| D�� | AlCl3��Һ�м��������İ�ˮ��Al3++3OH-�TAl��OH��3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ӵ�����Խ�ͣ��˶�������ԭ�Ӻ�ԽԶ | |
| B�� | ������ӵķֲ��Ų����Ǻ�����ӵķֲ��˶� | |
| C�� | ϡ������Ԫ��ԭ�ӵ�����㶼����8������ | |
| D�� | ��M���������ʱ��������18������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | ����98%��Ũ���� | ||
| C�� | ����п�� | D�� | �μ�����CuSO4��Һ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com