
制备氮化镁的装置示意图如下:

回答下列问题:
(1)检查装置气密性的方法是__________________________,
a的名称是________,b的名称是________。
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式________________________________。
(3)C的作用是________,D的作用是________,是否可以把C与D的位置对调并说明理由________。
(4)写出E中发生反应的化学方程式____________________。
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象___________________________________
(1)微热b,这时G中有气泡冒出,停止加热冷却后,G中插在溶液里的玻璃管形成一段水柱,则气密性良好 分液漏斗 圆底烧瓶
(2)(NH4)2SO4+2NaNO2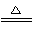 2N2↑+Na2SO4+4H2O
2N2↑+Na2SO4+4H2O
(3)除去氧气(及氮氧化物) 除去水蒸气 不能,对调后无法除去水蒸气
(4)N2+3Mg Mg3N2
Mg3N2
(5)取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(或把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上层清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁
【解析】(1)检查装置气密性时要将装置设置成密闭体系(关闭分液漏斗活塞并在G中加入水),然后利用热膨胀原理来检验。
(2)NaNO2中N元素显+3价,在反应中将(NH4)2SO4中-3价氮氧化,两者发生归中反应生成N2,根据电子守恒和质量守恒来配平化学方程式。
(3)由于开始装置中含有空气,故利用硫酸亚铁除去空气中的O2;浓硫酸的作用是作吸水剂,将生成的N2干燥。
(4)镁是活泼金属,在加热条件下能与氮气反应生成氮化镁。
(5)Mg3N2能与水反应生成NH3,故只要检验加入水后能否生成氨气即可知是否有Mg3N2生成;金属镁的检验可以通过加入酸来检验。
点拨:知识:对化学实验知识的考查,主要考查装置气密性的检验、仪器的名称与作用、镁的有关性质等。能力:考查考生根据实验目的推测装置作用的能力,根据氧化还原反应正确书写化学方程式的能力及实验设计能力。试题难度:中等。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题8电化学基础练习卷(解析版) 题型:选择题
关于铅蓄电池的说法正确的是( )。
A.在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-=PbSO4(s)
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题2化学常用计量练习卷(解析版) 题型:填空题
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
Ⅰ.过氧化钙晶体的制备。
工业上生产CaO2·8H2O的主要流程如下:

(1)用上述方法制取CaO2·8H2O的化学方程式是_________________________________。
(2)沉淀时常用冰水控制温度在10 ℃以下和通入过量的NH3,其可能原因分别是①__________________________;②_____________________________。
Ⅱ.过氧化钙晶体含量的测定。
准确称取0.300 0 g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.020 0 mol·L-1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
滴定终点观察到的现象为_______________________________________。
(4)根据表中数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)。
KMnO4标准溶液滴定数据
滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 0.300 0 | 1.02 | 24.04 |
2 | 0.300 0 | 2.00 | 25.03 |
3 | 0.300 0 | 0.20 | 23.24 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题14实验化学(选修)练习卷(解析版) 题型:选择题
以下实验原理或操作中,正确的是( )。
A.焰色反应实验中,铂丝在蘸取待测溶液前,应先用稀硫酸洗净并灼烧
B.做“钠与水的反应”实验时,应向一只盛有水的小烧杯中滴加几滴酚酞试液,然后将绿豆大小用滤纸吸干其表面的煤油的金属钠投入小烧杯中,观察并记录实验现象
C.纸层析中,滤纸作为固定相,展开剂作为流动相
D.室温下,含有CoCl2的干燥变色硅胶呈蓝色,在潮湿的空气中变粉红色,放在干燥的空气中又恢复为蓝色
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习提分训练 专题10金属元素及其化合物练习卷(解析版) 题型:选择题
FeSO4可发生如图所示的一系列反应,下列说法错误的是( )。

A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 综合实验设计与评价练习卷(解析版) 题型:选择题
下列实验方案设计正确的是( )
A.分解高锰酸钾制取氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤
B.失去标签的AgNO3溶液、稀盐酸、NaOH溶液、AlCl3溶液可选用(NH4)2CO3溶液作鉴别试剂
C.用铜丝代替铂丝做焰色反应
D.在裂化汽油中加入酸性高锰酸钾,振荡后若紫色褪去即可证明其中含甲苯等苯的同系物
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 离子反应、氧化还原反应练习卷(解析版) 题型:填空题
已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、ClO-、ClO3—三种含氯元素的离子,其中ClO-、ClO3—两种离子的物质的量(n)与反应时间(t)的曲线如图所示。

(1)t1前,氧化产物是______________________(填化学式)。
(2)t2时,Ca(OH)2与Cl2发生反应的总的离子方程式:_____________________________。
(3)该石灰乳中含有Ca(OH)2的物质的量是________mol。
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是________(填字母)。
A.NaCl、Cl2 B.NaCl、NaClO C.NaClO3、NaClO4 D.NaCl、NaClO3
(5)配平下列离子方程式:________Fe(OH)3+________ClO-+________OH-=________FeO42—+________Cl-+________H2O。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 电解质溶液练习卷(解析版) 题型:填空题
许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1)重晶石(BaSO4)常做胃肠道造影剂。
已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)= __。
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。
①检验晶体中含有NH4+的方法为 。
②等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2 b.NH4HSO4
c.(NH4) 2SO4 d.(NH4)2SO3,
其中c(NH4+)由大到小的顺序为 __(填选项字母)。
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为 __。
②用铂做电极,电解H2SO4和K2SO4的混合溶液可以制备K2S2O8,其阳极的电极反应式为 __,电解过程中阴极附近溶液的pH将 __(填“增大”“减小”或“不变”)。
③产品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g产品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以 __为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-=2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该产品中K2S2O8的质量分数为(杂质不参加反应) __(列式并计算)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 物质结构、元素周期律练习卷(解析版) 题型:填空题
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 L的H2(已折算成标准状况)。甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1请回答下列问题:
(1)甲的化学式是________;乙的电子式是________。
(2)甲与水反应的化学方程式是________。
(3)气体丙与金属镁反应的产物是________(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式__________________。有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证之______________________。
(已知:Cu2O+2H+=Cu+Cu2++H2O)
(5)甲与乙之间________(填“可能”或“不可能”)发生反应产生H2,判断理由是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com