
化学与生活、社会密切相关。下列说法正确的是
A.光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材料主要是SiO2
B.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂
C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性
D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源:2015届江苏省盐城市、建湖二中高二上期中化学试卷(必修)(解析版) 题型:选择题
下列溶液中的Cl?浓度与50mL1 mol·L-1MgCl2溶液中的Cl?浓度相等的是
A.100 mL 1 mol·L-1 NaCl溶液
B.150 mL 2 mol·L-1 KCl溶液
C.25 mL 2 mol·L-1 CaCl2溶液
D.75 mL 1 mol ·L-1 AlCl3溶液
查看答案和解析>>
科目:高中化学 来源:2015届河南省名校高三上学期期中考试理综化学试卷(解析版) 题型:填空题
(15分)I、用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+ CO2(g)+2H2O(g) △H= ?574 kJ·mol?l
②CH4(g)+4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) △H= ?1160 kJ·mol?l
③H2O(l)=H2O(g) △H=+44kJ·mol?l
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式___。
II、开发新能源和三废处理都是可持续发展的重要方面。CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
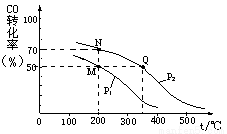
(1)M、N两点平衡状态下,容器中物质的总物质的量之比为:n(M)总:n(N)总= 。
(2)若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 ;P1 P2 (填“>” 或“<” 或“=”)
III、用MnO2制KMnO4的工艺流程如下图:电解池中两极材料均为碳棒,在中性或酸性溶液中K2MnO4发生歧化反应而变成MnO2和KMnO4。
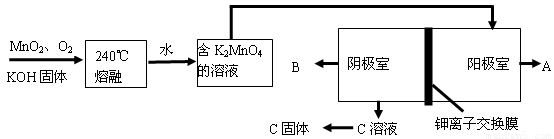
(1)写出240℃熔融时发生反应的化学方程式 ;投料时必须满足n(KOH):n(MnO2) 。
(2)阳极的电极反应式为 。
(3)B物质是 (填化学式),可以循环使用的物质是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源:2015届河南省原名校高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是
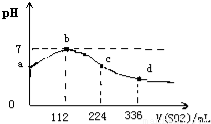
A.原H2S溶液的物质的量浓度为0.05 mol/L
B.氢硫酸的酸性比亚硫酸的酸性强
C.b点水的电离程度比c点水的电离程度大
D.a点对应溶液的导电性比d点强
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高三上学期摸底考试化学试卷(带析版) 题型:填空题
(8分)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
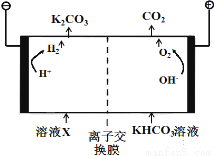
在阳极区发生的反应包括 和H ++ HCO3- == H2O + CO2↑。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
H2(g) +  O2(g) === H2O(g) Δ H1= —242 kJ·mol-1
O2(g) === H2O(g) Δ H1= —242 kJ·mol-1
CH3OH(g) + O2(g) === CO2 (g) + 2 H2O(g) Δ H2= —676 kJ·mol-1
O2(g) === CO2 (g) + 2 H2O(g) Δ H2= —676 kJ·mol-1
① 写出CO2和H2生成气态甲醇等产物的热化学方程式 。
② 下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。
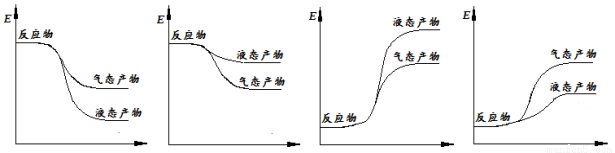
a b c d
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下:

①该电池外电路电子的流动方向为 (填写“从A到B”或“从B到A”)。
②A电极附近甲醇发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高三上学期摸底考试化学试卷(带析版) 题型:选择题
用石墨电极电解CuCl2溶液(见下图)。下列分析正确的是
A.通电使CuC12发生电离
B.a端是直流电源的负极
C.阳极上发生的反应:Cu2++2e- == Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
查看答案和解析>>
科目:高中化学 来源:2015届河北省衡水市高三上学期第一次月考化学试卷(解析版) 题型:填空题
(本题共10分)
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2=6SO2+Fe3O4,氧化产物为 ,若有3mol FeS2参加反应,转移 mol电子。
(2)与明矾相似,硫酸铁也可用作净水剂,其原理为 (用离子方程表示)。
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为 。
(4)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请写出相应的离子方程式: 。
(5)铁红是一种红色颜料,其成分是Fe2O3将一定量的铁红溶于160mL 5mol?L-1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为 。
查看答案和解析>>
科目:高中化学 来源:2015届河北省石家庄市五校联考高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.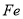 与稀
与稀 、稀
、稀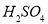 反应均有气泡产生,说明
反应均有气泡产生,说明 与两种酸均发生置换
与两种酸均发生置换
B. 中阴阳离子数数目之比为1:1
中阴阳离子数数目之比为1:1
C.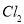 与
与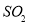 均能使品红褪色,说明二者均有氧化性
均能使品红褪色,说明二者均有氧化性
D.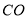 能够与人体里的血红蛋白结合,造成人体缺氧中毒
能够与人体里的血红蛋白结合,造成人体缺氧中毒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com