
(本题共10分)
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2=6SO2+Fe3O4,氧化产物为 ,若有3mol FeS2参加反应,转移 mol电子。
(2)与明矾相似,硫酸铁也可用作净水剂,其原理为 (用离子方程表示)。
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为 。
(4)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请写出相应的离子方程式: 。
(5)铁红是一种红色颜料,其成分是Fe2O3将一定量的铁红溶于160mL 5mol?L-1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24L(标准状况),经检测,溶夜中无Fe3+,则参加反应的铁粉的质量为 。
(1)SO2和Fe3O4 32 (2)Fe3++3H2O Fe(OH)3+3H+ (3)2Fe3++2I-=2Fe2++I2
Fe(OH)3+3H+ (3)2Fe3++2I-=2Fe2++I2
(4)3Fe2++NO3—+4H+ =3Fe3+ +NO↑+ 2H2O (5) 11.2g
【解析】
试题分析:(1)3FeS2+8O2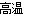 6SO2+Fe3O4中,Fe、S元素的化合价升高,O元素的化合价降低,SO2和Fe3O4为氧化产物。3molFeS2参加反应,由O元素的化合价变化可知,转移的电子为8mol×2×(2-0)=32mol;
6SO2+Fe3O4中,Fe、S元素的化合价升高,O元素的化合价降低,SO2和Fe3O4为氧化产物。3molFeS2参加反应,由O元素的化合价变化可知,转移的电子为8mol×2×(2-0)=32mol;
(2)硫酸铁溶于水Fe3+水解生成氢氧化铁胶体,胶体具有吸附性而净水,方程式为Fe3++3H2O Fe(OH)3+3H+;
Fe(OH)3+3H+;
(3)铁离子具有氧化性,能把碘离子氧化为单质碘,方程式为2Fe3++2I-=2Fe2++I2;
(4)在酸性条件下硝酸根具有氧化性,能把亚铁离子氧化为铁离子,而自身被还原为NO,反应的方程式为3Fe2++NO3—+4H+ =3Fe3+ +NO↑+ 2H2O;
(5)氢气的物质的量为2.24L÷22.4L/mol=0.1mol
Fe~~~~2HCl~~~H2
0.1mol 0.2mol 0.1mol
根据氯原子守恒,所以氯化铁的物质的量为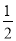 ×(0.16L×5mol/L-0.2mol)=0.2mol
×(0.16L×5mol/L-0.2mol)=0.2mol
Fe~~~2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为(0.1mol+0.1mol)×56g/mol=11.2g
考点:考查铁的化合物参与反应的有关判断与计算


科目:高中化学 来源:2015届河南省高二上学期期中考试化学试卷(解析版) 题型:选择题
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图。下列说法正确的是
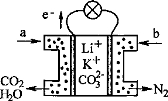
A.a为CH4,b为CO2
B.CO32—向正极移动
C.此电池在常温时也能工作
D.正极电极反应式为:O2+2CO2+4e—=2CO32—
查看答案和解析>>
科目:高中化学 来源:2015届河南省原名校高三上学期第一次摸底考试化学试卷(解析版) 题型:选择题
化学与生活、社会密切相关。下列说法正确的是
A.光纤通信使用的光缆的主要成分是晶体Si,太阳能电池使用的材料主要是SiO2
B.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂
C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性
D.SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高三上学期摸底考试化学试卷(带析版) 题型:选择题
下列叙述错误的是
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.铁管上镶嵌锌块,铁管不易被腐蚀
D.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高三上学期摸底考试化学试卷(带析版) 题型:选择题
化学与生活息息相关,下列说法不正确的是
A.干燥的Cl2和氯水均能使鲜花褪色
B.Si可用于制造半导体材料
C.次氯酸钠溶液是生活中常用的消毒剂
D.经常食用含明矾的食品能中和过多的胃酸
查看答案和解析>>
科目:高中化学 来源:2015届河北省衡水市高三上学期第一次月考化学试卷(解析版) 题型:选择题
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如下图所示)。下列说法错误的是

A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂
B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
查看答案和解析>>
科目:高中化学 来源:2015届河北省衡水市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:Fe3+ + 2I-= Fe2+ + I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3+ + SO42-+ Ba2+ + 3OH-= Fe(OH)3↓+ BaSO4↓
D. 1L0.1mol/L该溶液和足量的Zn充分反应,生成 11.2gFe
查看答案和解析>>
科目:高中化学 来源:2015届河北省衡水市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列试剂不会因为空气中的氧气而变质的是( )
A.过氧化钠 B.氢硫酸 C.硫酸亚铁 D.苯酚
查看答案和解析>>
科目:高中化学 来源:2015届江西省红色六校高三第一次联考化学试卷(解析版) 题型:填空题
(12分)阿司匹林(乙酰水杨酸, )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)
 与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
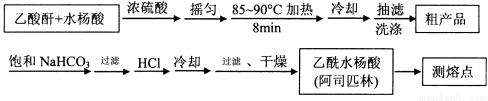
主要试剂和产品的物理常数

请根据以上信息回答下列问题:
(1)制备阿司匹林时,仪器应干燥,其原因是 。
该加热过程中,温度计控制 的温度
(2)写出制备阿司匹林的化学方程式 。
(3) ① 合成阿斯匹林时,加饱和NaHCO3的作用是 。
② 过滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是 。
(4)检验产品中是否含有水杨酸的试剂是 。
(5)该学习小组在实验中原料用量:2.0 g水杨酸、5.0 mL醋酸酐(ρ=1.08 g/cm3),最终称得产品m=2.1 g,则所得乙酰水杨酸的产率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com