
某一反应体系中存在以下五种物质:
Na3AsO3、H2O、I2、Na3AsO4、HI
(1)若水是产物,试用这五种物质组成一个合理的反应方程式,配平并标出电子转移的方向和数目: ;
(2)当pH为5~9时,该反应体系中的氧化反应为由HI→I2;当pH<4时,反应反方向进行,此时体系中的氧化反应为由 → 。如果两种情况下反应中转移电子数相等,则两个反应中氧化剂的物质的量之比是 ;
(3)物质的氧化性和还原性不仅与溶液的酸碱性有关,还与物质的浓度和反应温度等因素有关。下列各组物质由于浓度不同而发生不同氧化还原反应的是(填序号) 。
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Fe与HCl溶液 ④Fe与H2SO4溶液
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:阅读理解
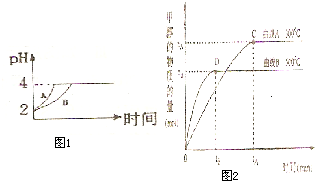 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| 2nB |
| 3tB |
| 2nB |
| 3tB |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
| 3 |
| 2 |
| 3 |
| 2 |
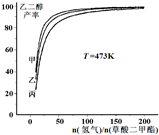 (氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=
(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H= —49.0kJ/mo1.
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
(2)该反应的平衡常数为 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入lmol CO2和3mol H2
(4)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H= —1275.6kJ/mol
②H2O(g)=H2O(1) △H= —44.0kJ/mol
则甲醇的燃烧热化学方程式为: ;
(5)如果燃烧甲醇会造成大量化学能损失,如果以甲醇和空气为原料,以氢氧化钠为电解质溶液设计成原电池将有很多优点,请书写出该电池的负极反应:___________________
(6)常温下,某水溶液M中存在的离子有:Na+、A—、H+、OH—。若该溶液M由 pH=3的HA溶液![]() mL与pH=11的NaOH溶液
mL与pH=11的NaOH溶液![]() mL混合反应而得,则下列说法中正确的是 __。
mL混合反应而得,则下列说法中正确的是 __。
A.若溶液M呈中性,则溶液M中c(H+)+c(OH—)=2×10—7mol·L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
查看答案和解析>>
科目:高中化学 来源:2012-2013学年北京市海淀区高三下学期期末练习理综化学试卷(解析版) 题型:填空题
发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值。下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:

(1)该过程中产生的的CO可继续与水蒸气发生可逆反应得到CO2和H2,此反应的平衡常数表达式K =____________。
(2)CH3OH(l)气化时吸收的热量为27 kJ/mol,CH3OH(g)的燃烧热为677 kJ/mol,请写出CH3OH(l)完全燃烧的热化学方程式_________________。
(3) “催化还原”反应制乙二醇原理如下:
CH3OOC-COOCH3(g)+4H2(g)
 HOCH2-CH2OH(g)+2CH3OH(g)
△H = -34 kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g)
△H = -34 kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究。下图表示乙二醇达到平衡时的产率随原料投料比[n(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5 MPa、2.5 MPa、3.5 MPa的情况,则曲线甲对应的压强是P(甲)=___________。

(4)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸
① 草酸氢钾溶液中存在如下平衡:
H2O H++OH-、HC2O4-
H++OH-、HC2O4- H++C2O42-和
。
H++C2O42-和
。
② 向0.1 mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是 (填序号)。
a.c(K+) = c(HC2O4-) + c(H2C2O4) + c(C2O42-)
b.c(K+) + c(Na+) = c(HC2O4-) + c(C2O42-)
c.c(Na+) = c(H2C2O4) + c(C2O42-)
d.c(K+) > c(Na+)
(5)以甲醇为原料,使用酸性电解质构成燃料电池,该燃料电池的负极反应式为 ;若以甲烷代替该燃料电池中的甲醇,向外界提供相等电量,则每代替32 g甲醇,所需标准状况下的甲烷的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年陕西省高三第二次模拟考试化学试卷 题型:填空题
(12分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H
= —49.0kJ/mo1.
CH3OH(g)+H2O(g) △H
= —49.0kJ/mo1.
测得CO2和CH3OH(g)的浓度随时间变化如图所示。

(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L·min)
(2)该反应的平衡常数为 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入lmol CO2和3mol H2
(4)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H= —1275.6kJ/mol
②H2O(g)=H2O(1) △H= —44.0kJ/mol
则甲醇的燃烧热化学方程式为: ;
(5)如果燃烧甲醇会造成大量化学能损失,如果以甲醇和空气为原料,以氢氧化钠为电解质溶液设计成原电池将有很多优点,请书写出该电池的负极反应:___________________
(6)常温下,某水溶液M中存在的离子有:Na+、A—、H+、OH—。若该溶液M由 pH=3的HA溶液 mL与pH=11的NaOH溶液
mL与pH=11的NaOH溶液 mL混合反应而得,则下列说法中正确的是 __。
mL混合反应而得,则下列说法中正确的是 __。
A.若溶液M呈中性,则溶液M中c(H+)+c(OH—)=2×10—7mol·L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com