
【题目】资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品。
(1)以CO2与NH3为原料可合成化肥尿素[CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H =-159.47 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H =+116.49 kJ·mol-1
③H2O(l)=H2O(g)△H =+88.0 kJ·mol-1
试写出NH3和CO2合成尿素和液态水的热化学方程式______________。
(2)已知:
化学键 | Si—Cl | H—H | H—Cl | Si—Si |
键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键。工业上所用的高纯硅可通过下列应反制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的△H=___ kJ·mol-1。
Si(s)+4HCl(g),该反应的△H=___ kJ·mol-1。
(3)在一定条件下,二氧化碳转化为甲烷的反应如下:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____、_____,CO2的平衡转化率为______。
CH4(g)+2H2O(g) ΔH<0向一容积为2L的恒容密闭容器中充入一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2:0.2mol·L-1,H2:0.8mol·L-1,CH4:0.8mol·L-1,H2O:1.6mol·L-1,起始充入CO2和H2的物质的量分别为_____、_____,CO2的平衡转化率为______。
(4)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为
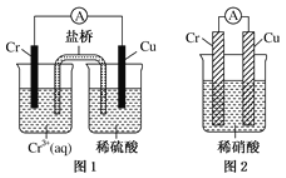
① ____________________________________。
② ____________________________________。
【答案】2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l) △H =-130.98 kJ·mol1 +236 2mol 8mol 80% 金属铬的活泼性比铜强且能和稀硫酸反应生成H2 金属铬易被稀硝酸钝化
【解析】
(1)根据盖斯定律计算;
(2)根据焓变等于反应物的总键能减去生成物的总键能进行计算;
(3)依据化学平衡三段式列式计算;
(4)图1装置铜电极上产生大量的无色气泡,说明Cr的活泼性大于Cu,能和稀硫酸反应生成H2;而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体,说明Cr和硝酸能产生钝化现象。
(1)①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-159.47kJmol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.49kJmol-1
③H2O(l)=H2O(g)△H=+88.0kJmol-1
依据盖斯定律:①+②-③得:
2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)△H=-130.98 kJmol-1;
(2) △H=反应物的总键能-生成物的总键能=4×360+2×436-2×176-4×431=+236(kJ·mol-1)
(3)向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2molL-1,H2 0.8molL-1,CH4 0.8molL-1,H2O 1.6molL-1 ,起始充CO2和H2的物质的量分别为x、y;
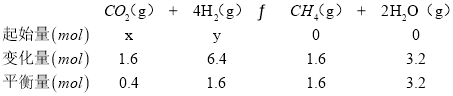
x=1.6mol+0.4mol=2mol,y=6.4mol+1.6mol=8mol;
CO2的平衡转化率=![]() ×100%=80%;
×100%=80%;
(4)由图1可知还原性Cr>Cu,但在稀硝酸中却出现了反常,结合稀硝酸的氧化性,不难推测铬被稀硝酸钝化,导致活性降低,
故答案为:①金属铬的活泼性比铜强且能和稀硫酸反应生成H2;②金属铬易被稀硝酸钝化。


科目:高中化学 来源: 题型:
【题目】下图为室温时不同pH下磷酸盐溶液中含磷微粒形态的分布,其中a、b、c三点对应的pH分别为2.12、7.21、11.31,其中δ表示含磷微粒的物质的量分数,下列说法正确的是
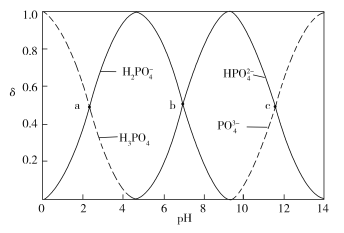
A.2 mol H3PO4与3 mol NaOH反应后的溶液呈中性
B.NaOH溶液滴定Na2HPO4溶液时,无法用酚酞指示终点
C.H3PO4的二级电离常数的数量级为107
D.溶液中除OH离子外,其他阴离子浓度相等时,溶液可能显酸性、中性或碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有化合物:
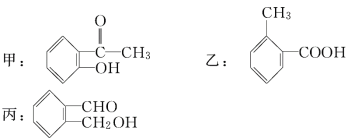
(1)请写出丙中含氧官能团的名称:_____________________。
(2)请判别上述哪些化合物互为同分异构体:________________________________。
(3)请分别写出鉴别甲的方法。(指明所选 试剂及主要现象即可)鉴别甲的方法:____________________________
(4)请按酸性由强至弱排列甲、乙、丙的顺序:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述的化学反应状态,不一定是平衡状态的是( )
A.H2(g)+Br2(g) ![]() 2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
2HBr(g),恒温、恒容下,反应体系中气体的颜色保持不变
B.2NO2(g) ![]() N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
N2O4(g),恒温、恒容下,反应体系中气体的压强保持不变
C.CaCO3(s)![]() CO2(g)+ CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
CO2(g)+ CaO(s),恒温、恒容下,反应体系中气体的密度保持不变
D.N2(g)+3H2(g) ![]() 2NH3(g),反应体系中H2与N2的物质的量之比保持3:1
2NH3(g),反应体系中H2与N2的物质的量之比保持3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(11分)近年来,随着锂离子电池的广泛应用,废锂离子电池的回收处理至关重要。下面是利用废锂离子电池正极材料(有Al、LiCoO2、Ni、Mn、Fe等)回收钴、镍、锂的流程图。
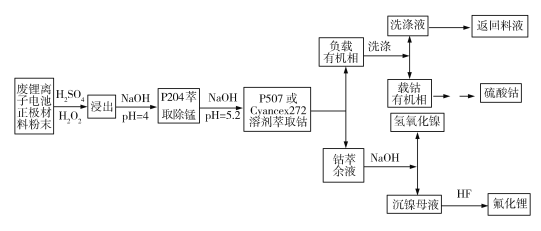
已知:P204[二(2乙基己基)磷酸酯]常用于萃取锰,P507(2乙基己基膦酸2乙基己酯)和Cyanex272[二(2,4,4)三甲基戊基次磷酸]常用于萃取钴、镍。
回答下列问题:
(1)在硫酸存在的条件下,正极材料粉末中LiCoO2与H2O2反应能生成使带火星木条复燃的气体,请写出反应的化学方程式__________________________________。
(2)一些金属难溶氢氧化物的溶解度(用阳离子的饱和浓度表示)与pH的关系图如下:
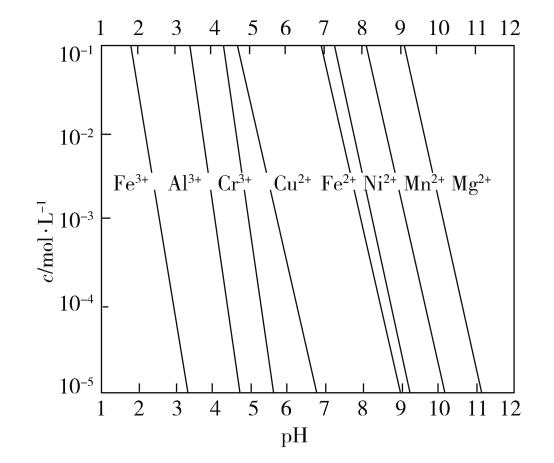
加入NaOH溶液调pH=5可除去图中的________(填金属离子符号)杂质;写出除去金属离子的离子方程式________________________(一种即可)。
(3)已知P507萃取金属离子的原理为nHR(Org)+Mn+(aq)![]() MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)
MRn(Org)+nH+(aq),且随着萃取过程中pH降低,萃取效率下降。萃取前先用NaOH对萃取剂进行皂化处理,皂化萃取剂萃取金属离子的反应为nNaR(Org)+Mn+(aq)![]() MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为________________。
MRn(Org)+nNa+(aq)。对萃取剂进行皂化处理的原因为________________。
(4)控制水相pH=5.2,温度25℃,分别用P507、Cyanex272作萃取剂,萃取剂浓度对萃取分离钴、镍的影响实验结果如图所示。
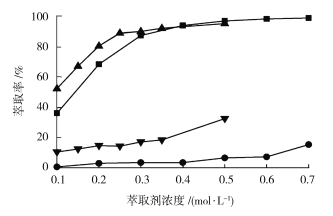
■—Co(Cyanex272);●—Ni(Cyanex272);▲—Co(P507);▼—Ni(P507)
由图可知,钴、镍的萃取率随萃取剂浓度增大而_________(填“增大”或“减小”);两种萃取剂中___________(填“P507”或“Cyanex272”)的分离效果比较好,若选P507为萃取剂,则最适宜的萃取剂浓度大约为__________mol·L1;若选Cyanex272萃取剂,则最适宜的萃取剂浓度大约为___________mol·L1。
(5)室温下,用NaOH溶液调节钴萃余液的pH=12,搅拌一段时间后,静置,离心分离得到淡绿色氢氧化镍固体,镍沉淀率可达99.62%。已知Ksp[Ni(OH)2]=5.25×1016,则沉镍母液中Ni2+的浓度为2.1×1011 mol·L1时,pH=______(lg5=0.7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是
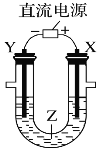
A. 氯碱工业中,X电极上反应式是4OH--4e-=2H2O+O2↑
B. 电解精炼铜时,Z溶液中的铜离子浓度不变
C. 在铁片上镀铜时,Y是纯铜
D. 电解水制氢气时,Z可以是稀硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
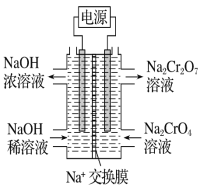
【题目】已知水溶液中CrO42-(黄色)和 Cr2O72-(橙色)间存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O △H<0
Cr2O72-+H2O △H<0
(1)该反应平衡常数的表达式为_______________________
(2)下列说法正确的是_________
A、V正(CrO42—)=2V逆(Cr2O72—)说明该反应已达平衡状态
B、溶液颜色不变说明该反应已达平衡状态
C、溶液中c(CrO42—):c(Cr2O72—)=2:1时该反应已达平衡状态
D、升温该反应平衡常数变大
E、向平衡后的体系中加入一定量的水,平衡不移动
(3)根据2CrO42-+2H+![]() Cr2O72-+H2O设计图示装置(两极均为惰性电极)电解Na2CrO4 溶液制取Na2Cr2O7图中右侧电极连接电源的______极,其电极反应式为______________
Cr2O72-+H2O设计图示装置(两极均为惰性电极)电解Na2CrO4 溶液制取Na2Cr2O7图中右侧电极连接电源的______极,其电极反应式为______________
(4)H+(aq)+OH-(aq)=H2O(l);ΔH= -a KJ/mol
3Cl2(g)+2Cr3+(aq)+16OH-(aq)=2CrO42-(aq)+6Cl-(aq)+8H2O(l);ΔH= -b KJ/mol
2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l);ΔH= -c KJ/mol
Cr2O72-(aq)+H2O(l);ΔH= -c KJ/mol
已知酸性条件下Cr2O72—将Cl-氧化为Cl2,本身被还原为Cr3+,试写出该反应的热化学方程式:_______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均含有同一种元素,它们之间的转化关系如图所示(反应条件及其他物质已经略去) A ![]() B
B ![]() C
C ![]() D
D
I、若A是一种黄色固体单质;B为酸雨的成因之一,且可使品红溶液褪色,回答以下问题:
(1)将B通入KMnO4溶液的现象为:_____;体现B的____(选填“氧化性”“还原性”“漂白性”);
(2)请写出D的浓溶液与单质铜反应的化学方程式:_____.
Ⅱ、若A气体可使湿润的红色石蕊试纸变蓝,则回答下列问题
(1)写出A→B的化学反应方程式_________
(2)实验室常用图所示装置制取并收集A气体,请在框中画出实验室收集A气体的装置图_____
(3)尾气处理装置中使用倒扣漏斗的作用是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com