
下列有关化学键和化合物的叙述正确的是
①共价化合物中只有共价键,离子化合物中一定有离子键
②只含共价键的物质一定是共价化合物
③离子化合物中一定有非金属元素
④离子键和极性键只存在于化合物中
⑤两个非金属原子间不可能形成离子键
A.①②⑤ B.②③④ C.①③④⑤ D.①③⑤
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源:2016届黑龙江省高三上期中测试化学试卷(解析版) 题型:选择题
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示。由图可得出的正确结论是

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.Δt1=Δt2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光中学高一上10月月考化学试卷(解析版) 题型:填空题
(14分)填空:
(1)含0.4mol A13+的Al2(SO4)3中所含的SO42-的物质的量是_____________;
(2)已知16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量为______________;
(3)如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是(设NA为阿伏加德罗常数)____________________。
(4)在标准状况下,44.8L的NH3气体质量为 g, 其中含 个氢原子,其中含 molN, 将其溶于水配成200mL的溶液,其物质的量浓度为_ mol/L。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期中测试化学试卷(解析版) 题型:选择题
铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,如图所示,四种物质间反应的离子方程式书写不正确的是
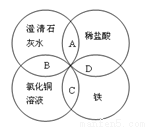
A.OH-+H+===H2O B.2OH-+Cu2+===Cu(OH)2↓
C.Fe+Cu2+===Cu+Fe2+ D.Fe+2H+===Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.NO2,SO2,BF3,NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B.P4和CH4都是正四面体分子且键角都为109o28ˊ
C.NaCl晶体中与每个Na+距离相等且最近的Na+共有6个
D.单质的晶体中一定不存在的微粒是阴离子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上第一阶段测化学试卷(解析版) 题型:选择题
下列叙述中,不能用平衡移动原理解释的是
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D.黄绿色的氯水光照后颜色变浅
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春市高三上学期期中测试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列说法不正确的是
A.含1 mol FeCl3的饱和溶液最多可形成胶体粒子数为NA
B.4.6 g Na与足量的稀盐酸反应,转移电子数一定为0.2NA
C.10.6 g Na2 CO3晶体中含CO32一数目为0.1 NA
D.常温下,22 g CO2含碳氧双键数目为NA
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期第一次模拟化学试卷(解析版) 题型:选择题
下列有关物质组成、性质和用途的说法,正确的是
A.钠、钾合金(液态)可用于原子反应堆的导电材料
B.煤是由有机物和少量无机物组成的复杂混合物,主要含有苯
C.氮化硅、光导纤维、氧化铝陶瓷等属于新型无机非金属材料
D.化学纤维是把合成纤维经过化学处理得到的高分子材料
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南洛阳高级中学高二上9月月考化学试卷(解析版) 题型:填空题
(共11分)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
平衡气体总浓度 | |||||
(×10-3 mol·L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
(1)氨基甲酸铵(NH2COONH4)分解反应平衡常数K的表达式为_____ __。
(2)判断氨基甲酸铵分解反应的ΔH____________0(填“>”、“<”或“=”),其原因是什么?
(3)判断氨基甲酸铵分解反应的ΔS____ _0(填“>”、“<”或“=”),该反应在任何温度下是否一定能自发进行?
(4)升高温度,化学平衡常数K如何变化? 增大容器的压强,K值如何变化? (填“变大”“变小”或“不变”)
(5)根据表格中的数据,计算25℃时,氨基甲酸铵的分解平衡常数
(6)将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡,判断该分解反应已经达到化学平衡的是( )
A.2v(NH3)=v(CO2) B.密闭容器中混合气体平均分子量不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com