
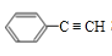
【题目】已知:CH3—CH=CH2+HBr→CH3—CHBr—CH3(主要产物)。1mol某芳香烃A充分燃烧后可得到8molCO2和4molH2O。该烃A在不同条件下能发生如图所示的一系列变化。
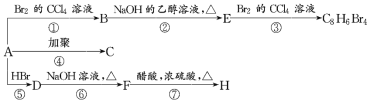
(1)A的化学式:______,A的结构简式:______。
(2)上述反应中,①是______ (填反应类型,下同)反应,⑦是______反应。
(3)写出C、D、E、H的结构简式:
C______,D______,E______,H______。
(4)写出反应D→F的化学方程式:______。
【答案】C8H8 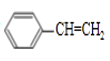 加成反应 取代反应(或酯化反应)
加成反应 取代反应(或酯化反应) 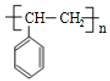
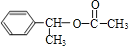
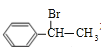 +NaOH
+NaOH![]()
![]() +NaBr
+NaBr
【解析】
1mol某烃A充分燃烧后可以得到8molCO2和4molH2O,故烃A的分子式为C8H8,不饱和度为![]() ,可能含有苯环,由A发生加聚反应生成C,故A中含有不饱和键,故A为
,可能含有苯环,由A发生加聚反应生成C,故A中含有不饱和键,故A为 ,C为
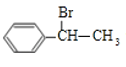
,C为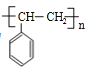 ,A与溴发生加成反应生成B,B为
,A与溴发生加成反应生成B,B为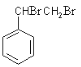 ,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,E为
,B在氢氧化钠醇溶液、加热条件下发生消去反应生成E,E为![]() ,E与溴发生加成反应生成
,E与溴发生加成反应生成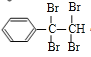 ,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上,
,由信息烯烃与HBr的加成反应可知,不对称烯烃与HBr发生加成反应,H原子连接在含有H原子多的C原子上, 与HBr放出加成反应生成D,D为
与HBr放出加成反应生成D,D为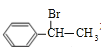 ,
,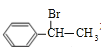 在氢氧化钠水溶液、加热条件下发生水解反应生成F,F为
在氢氧化钠水溶液、加热条件下发生水解反应生成F,F为![]() ,F与乙酸发生酯化反应生成H,H为
,F与乙酸发生酯化反应生成H,H为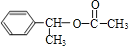 ,据此分析解答。
,据此分析解答。
(1)由上述分析可知,A的化学式为C8H8,结构简式为 ,故答案为:C8H8;
,故答案为:C8H8; ;
;
(2)上述反应中,反应① 与溴发生加成反应生成
与溴发生加成反应生成 ;反应⑦是
;反应⑦是![]() 与乙酸发生酯化反应生成
与乙酸发生酯化反应生成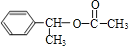 ,故答案为:加成反应;取代反应(或酯化反应);
,故答案为:加成反应;取代反应(或酯化反应);
(3)由上述分析可知,C为 ;D为
;D为 ;E为
;E为 ;H为
;H为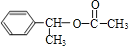 ;故答案为:
;故答案为:  ;
;  ;
;  ;
; 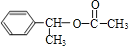 ;
;
(4)D→F为水解反应,方程式为: 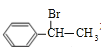 +NaOH
+NaOH![]()
![]() +NaBr,故答案为:
+NaBr,故答案为: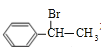 +NaOH
+NaOH![]()
![]() +NaBr。
+NaBr。


科目:高中化学 来源: 题型:
【题目】某混合溶液中可能大量含有的离子如下表所示:
阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
阴离子 | Cl-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示。

(1)该溶液中一定含有的阳离子是________________________________,其对应物质的量浓度之比为 ____________,溶液中一定不存在的阴离子是_______________________。
(2)写出沉淀减少的离子方程式 ________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,金属单质X和非金属单质Y能够反应,生成化合物Z,Z能与水发生水解反应生成气体G和白色沉淀P(如下框图所示),已知气体G与空气之密度比约为1.17。请填空:
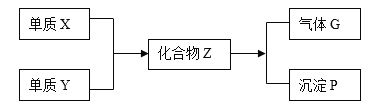
(1)组成单质X和Y的元素分别属第____________族和第___________族;
(2)Z与水发生水解反应方程式_____________________;
(3)每生成1mol的化合物Z,反应中转移_________________mol的电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究![]() 、
、![]() 、
、![]() 等的处理方法对环境保护有重要意义。
等的处理方法对环境保护有重要意义。
(1)科学家正在研究利用催化技术将尾气中的NO和CO转变成![]() 和
和![]() ,其反应为:
,其反应为:![]()
![]()
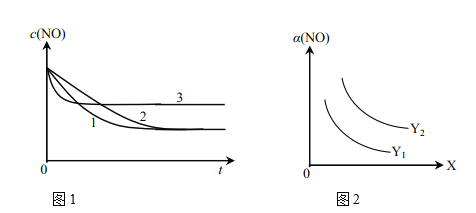
①为了研究外界条件对该反应的影响,进行下表三组实验,测得不同时刻NO的浓度(c)随时间变化的趋势如图1所示。1、2、3代表的实验编号依次是________。(已知在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。)
实验温度NO初始浓度O初始浓度催化剂比表面积催化剂用量编号(℃)
实验 编号 | 温度 (℃) | NO初始浓度
| CO初始浓度
| 催化剂比表面积
| 催化剂用量 (g) |
Ⅰ | 280 |
|
| 82 | 50 |
Ⅱ | 280 |
|
| 124 | 50 |
Ⅲ | 350 |
|
| 124 | 50 |
②图2表示NO的平衡转化率(a)随温度、压强变化的示意图。X表示的是________,理由是________;Y表示的是________,且Y1________Y2(填“>”或“<”)。
(2)一定温度下,将![]() 与
与![]() 以体积比1:2置于密闭容器中发生反应
以体积比1:2置于密闭容器中发生反应![]() ,达到平衡时
,达到平衡时![]() 的体积分数为25%。该反应的平衡常数
的体积分数为25%。该反应的平衡常数![]() ________。
________。
(3)利用原电池反应可实现![]() 的无害化,总反应为
的无害化,总反应为 ,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为________。
,电解质溶液为碱性。工作一段时间后,该电池负极区附近溶液pH________(填“变大”、“变小”或“不变”),正极电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为____________,S、O、N三种元素的第一电离能由大到小为____________。
(2)SO42-的立体构型是________,与SO42-互为等电子体的一种分子为____________(填化学式)。
(3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO3-中心原子的杂化轨道类型为________,[Cu(NH3)4](NO3)2中存在的化学键类型除了极性共价键外,还有____________。
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是____________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数为________,它代表________原子。
)。则D原子的坐标参数为________,它代表________原子。
②若Cu2O晶体密度为d g·cm-3,晶胞参数为a pm,则阿伏加德罗常数值NA=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
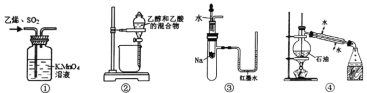
A.用装置①除去C2H4中少量SO2B.用装置②分离乙醇和乙酸的混合物
C.用装置③验证Na和水反应为放热反应D.用装置④分馏石油并收集60~ 150℃馏分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生反应:NO2(g)+ SO2(g)![]() SO3(g)+NO(g),下列能说明反应达到反应限度的是
SO3(g)+NO(g),下列能说明反应达到反应限度的是
A. 体系压强保持不变B. 混合气体颜色保持不变
C. SO3和NO的体积比保持不变D. 每消耗1 mol SO3的同时生成1 mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种有机烯醚,可以用烃A通过下列路线制得:
是一种有机烯醚,可以用烃A通过下列路线制得:
![]()
则下列说法正确的是( )
A.![]() 的分子式为C4H4O
的分子式为C4H4O
B.A的结构简式是CH2=CHCH2CH3
C.①②③的反应类型分别为卤代、水解、消去
D.A能使酸性高锰酸钾酸性溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)在25℃、101kPa时,1.00g C6H6(l)燃烧生成CO2和H2O(l)时,放出41.8kJ的热量,表示C6H6(l)燃烧热的热化学方程式为___。
(2)1.00L 1.00mol/LH2SO4溶液与2.00L 1.00mol/L NaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为___。
(3)已知反应CH3-CH3→CH2=CH2(g)+H2(g),有关化学键的键能如下:
化学键 | C-H | C=C | C-C | H-H |
键能E/kJ/mol | 414.4 | 615.3 | 347.4 | 435.3 |
通过计算得出该反应的反应热为_______________。
(4)已知2.0g燃料肼(N2H4)气体完全燃烧生成N2和H2O(g)时,放出33.4kJ的热量,则该反应的热化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com