
| A����500�桢20MPa��5L���ܱ������н��кϳɰ��ķ�Ӧ��ʹ�ô�����Kֵ���� |
| B��������K(HCN)��K(CH3COOH)��˵��CH3COOH�ĵ����һ����HCN�� |
| C��25��ʱ��pH ��Ϊ4�������NH4I(aq)��KW����� |
D��2SO2+O2 2SO3��ƽ��ı�ijһ����Kֵ���䣬SO2��ת���ʿ�������С�� 2SO3��ƽ��ı�ijһ����Kֵ���䣬SO2��ת���ʿ�������С�� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 p C��ij�¶��´ﵽƽ��
p C��ij�¶��´ﵽƽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH��g��
CH3OH��g��| �¶�/�� | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| ���� | �� | �� | �� | |
| Ͷ�Ϸ�ʽ | 1molCO��2molH2 | 1molCH3OH | 2molCH3OH | |
| ƽ������ | C(CH3OH)/(mol/L) | c1 | c2 | c3 |
| ��ϵѹǿ(Pa) | p1 | p2 | p3 | |
| ��Ӧ�������仯 | akJ | bkJ | ckJ | |
| ԭ��ת���� | ��1 | ��2 | ��3 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 H2S(g) ��H=��21��6kJ��mol��1����Ӧ�ﵽƽ��ʱH2��S��H2S�����ʵ�����Ϊ3 mol����380 Kʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ______�����жԸ÷�Ӧ������ȷ����______(����ĸ���)��
H2S(g) ��H=��21��6kJ��mol��1����Ӧ�ﵽƽ��ʱH2��S��H2S�����ʵ�����Ϊ3 mol����380 Kʱ�÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ______�����жԸ÷�Ӧ������ȷ����______(����ĸ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�| �¶�/ �� | 700 | 800 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
 A(g)+B(g)��ƽ�ⳣ����ֵΪ ��
A(g)+B(g)��ƽ�ⳣ����ֵΪ ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 B(g)+C(g)����H ="-48.25" kJ �� mol��1��Ӧ������ʱ��t��A ��BŨ������ͼ��ʾ��ϵ������õ�15minʱc(B)="1.6" mol��L��1�������н�����ȷ����
B(g)+C(g)����H ="-48.25" kJ �� mol��1��Ӧ������ʱ��t��A ��BŨ������ͼ��ʾ��ϵ������õ�15minʱc(B)="1.6" mol��L��1�������н�����ȷ����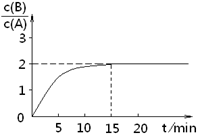
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 xC(g) ��H��0�������������c(A)��ʱ��t�ı仯����ͼ��ʾ������˵������ȷ����
xC(g) ��H��0�������������c(A)��ʱ��t�ı仯����ͼ��ʾ������˵������ȷ����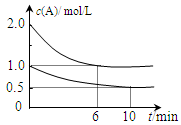
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
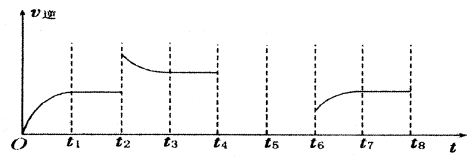
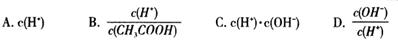
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
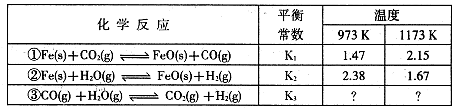
 H2 (g) +CO2 (g)ƽ�ⳣ��K���¶ȵı仯���±���
H2 (g) +CO2 (g)ƽ�ⳣ��K���¶ȵı仯���±���
 2CO (g)ƽ�ⳣ��K1��
2CO (g)ƽ�ⳣ��K1�� CO(g) +H2 (g)ƽ�ⳣ��K2��K��K1��K2,֮��Ĺ�ϵ�� :
CO(g) +H2 (g)ƽ�ⳣ��K2��K��K1��K2,֮��Ĺ�ϵ�� :�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com