
 CO��g��+3H2��g��;��H=+206��lkJ��mol-l��
CO��g��+3H2��g��;��H=+206��lkJ��mol-l��
| A��v������>v���棩 | B��v������<v���棩 |
| C��v������=v���棩 | D�����ж� |
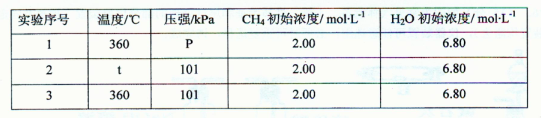
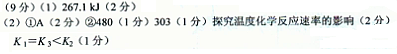
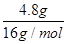 ��890.3kJ?mol-1=267.1kJ��
��890.3kJ?mol-1=267.1kJ��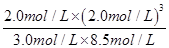 =0.63��С��ƽ�ⳣ��k=1�����Է�Ӧ������Ӧ���У���v��������v���棩��
=0.63��С��ƽ�ⳣ��k=1�����Է�Ӧ������Ӧ���У���v��������v���棩��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g)��H2O(g) ��
CH3OH(g)��H2O(g) ��
 CH3OH (g) ��H����90.8 kJ��mol-1
CH3OH (g) ��H����90.8 kJ��mol-1 CH3OCH3(g)��H2O(g) ��H����23.5 kJ��mol-1
CH3OCH3(g)��H2O(g) ��H����23.5 kJ��mol-1 CO2 (g)��H2(g) ��H����41.3 kJ��mol-1
CO2 (g)��H2(g) ��H����41.3 kJ��mol-1| A�����¸�ѹ |
| B��������� |
| C������CO2��Ũ�� |
| D������CO��Ũ��E������������� |
 CH3OCH3(g)��H2O(g)��ij�¶��µ�ƽ�ⳣ��K = 400�����¶��£����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
CH3OCH3(g)��H2O(g)��ij�¶��µ�ƽ�ⳣ��K = 400�����¶��£����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�| ���� | CH3OH | CH3OCH3 | H2O |
| c / mol��L-1 | 0.44 | 0.60 | 0.60 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 xC(g)�������� C�ڷ�Ӧ������еİٷֺ�����C%���ͷ�Ӧʱ�䣨t���Ĺ�ϵ��
xC(g)�������� C�ڷ�Ӧ������еİٷֺ�����C%���ͷ�Ӧʱ�䣨t���Ĺ�ϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2SO3��g�� ��H����196.6 kJ��mol-1
2SO3��g�� ��H����196.6 kJ��mol-1 2NO2��g�� ��H����113.0 kJ��mol-1
2NO2��g�� ��H����113.0 kJ��mol-1 SO3��g��+NO��g���Ħ�H�� kJ��mol-1��
SO3��g��+NO��g���Ħ�H�� kJ��mol-1�� CH3OH��g����
CH3OH��g����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

A�����ˮ���⣺2H2O 2H2����O2�� 2H2����O2�� |
B������ʹˮ�ֽ����⣺2H2O 2H2����O2�� 2H2����O2�� |
C��̫������ֽ�ˮ���⣺2H2O 2H2����O2�� 2H2����O2�� |
D����Ȼ�����⣺CH4��H2O CO��3H2 CO��3H2 |
 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g) 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��KW����Һ�¶ȡ�Ũ�ȵĸı���ı� |
| B������������ԭ��Ӧ�����Ƿ��ȷ�Ӧ |
| C�����Ѵﵽ��ѧƽ��ķ�Ӧ���ı�ѹǿ��ƽ��һ���ı� |
| D��������ʵĵ���̶ȣ����¶ȡ�Ũ�Ⱦ��й�ϵ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 ������5 min��ﵽƽ��״̬������ʱ���CH3OH������Ũ��Ϊ2 mol /L����
������5 min��ﵽƽ��״̬������ʱ���CH3OH������Ũ��Ϊ2 mol /L�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ | B������ϡ���ᣬ������������Ϊ98%��Ũ���� |
| C��������Ƭ������þ�� | D��������Ƭ���������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com