
【题目】用FeCl3溶液蚀刻铜箔回收铜的一种流程如图所示。下列叙述正确的是
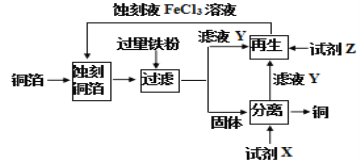
A.蚀刻铜箔的离子方程式:2Cu+Fe3+→2Cu2++Fe2+B.试剂X是盐酸或稀硝酸
C.滤液Y呈浅绿色D.试剂Z只能是氯水
科目:高中化学 来源: 题型:
【题目】下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是
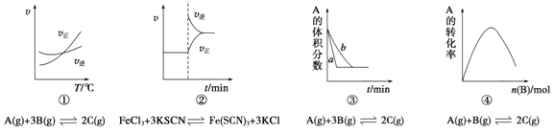
A. ①是其他条件一定时,反应速率随温度变化的图像,则正反应ΔH>0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后,化学反应速率随时间变化的图像
C. ③是在有无催化剂存在条件下,建立平衡过程的图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的恒容密闭容器中逐渐加入B,达平衡时A的转化率的图像
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近在-100 ℃的低温下合成一种烃X,此分子的模型如下图(图中的连线表示化学键),下列说法正确的是( )
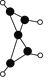
A. X能使溴的四氯化碳溶液褪色
B. X是一种在常温下能稳定存在的液态烃
C. X分子中在同一平面上的碳原子最多有5个
D. 充分燃烧等质量的X和甲烷,X消耗氧气多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】网络表情包“苯宝宝装纯(醇)”,该分子由“苯宝宝”拿一个氢原子换了个羟基形成,下列说法不正确的是
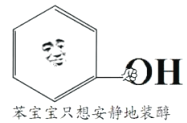
A. 苯宝宝只想安静地装醇,说明该分子不是醇
B. 该分子中所有原子一定共面
C. 该分子能和Na发生置换反应生成H2
D. 该分子苯环上的一个氢原子被-C4H9取代所得的同分异构体有12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁分别是Na2CO3溶液、AgNO3溶液、BaCl2 溶液、盐酸四种无色溶液中的一种,现进行了如图所示的实验。

(1)通过上述实验判断出各物质:甲___、乙___、丙___、丁____。写出甲与乙反应的离子方程式:___。
(2)实验室有一瓶标签破损(如图所示)的固体试剂。某同学应用(1)中的BaCl2溶液检验,取试剂瓶中的固体少量于试管中,加适量蒸馏水溶解,在所得溶液中加入过量BaCl2溶液,得到白色沉淀。由此,该同学推断这瓶试剂是硫酸钠。你认为他的结论是否正确? _____(填“正确”或“不正确”)。若正确,请写出相应反应的离子方程式__________;若不正确, 请说明可能的结论:_______(填物质的化学式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①I2(g)+H2(g)![]() 2HI(g)+26.5kJ、②I2(s)+H2(g)
2HI(g)+26.5kJ、②I2(s)+H2(g)![]() 2HI(g)-9.5kJ,下列分析正确的是
2HI(g)-9.5kJ,下列分析正确的是
A.①是放热反应,无需加热即可发生
B.②需持续不断加热才能发生反应
C.I2(g)和I2(s)的能量关系如图所示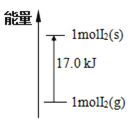
D.1molI2(s)和1molH2(g)的能量之和比2molHI(g)能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将250mL含BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则原混合溶液中钾离子物质的量浓度为
A. 4(b-2a)mol/L B. 20(2a-b)mol/L
C. 20(b-2a)mol/L D. 10(b-a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是人体及动植物必需的微量元素,且在芯片制作、药物和医学造影等方面也有重要作用。用辉钼矿冶炼金属钼的某反应:MoS2(s)+2Na2CO3(s)+4H2(g)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),该反应中氢气的平衡转化率与温度、压强的关系如图所示:
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),该反应中氢气的平衡转化率与温度、压强的关系如图所示:
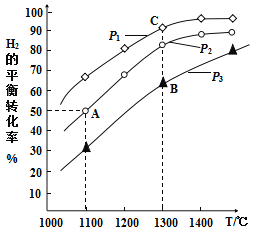
(1)Na2S的电子式为:____________。上述反应的气态反应物和生成物中属于极性分子的是____________(填写化学式)。举出一个事实,说明硫的非金属性比碳强(用化学方程式表示)____________。
(2)写出上述反应的平衡常数表达式K=____________。上述正反应是____________反应(填“吸热”或“放热”)。
(3)1100℃,2L恒容密闭容器中,加入0.1molMoS2、0.2molNa2CO3、0.4molH2,反应至20min时达到的平衡状态恰好处于上图中的A点。此过程中,用H2表示的平均速率为____________。其他条件一定时,B点的速率____________C点(填“大于”“等于”或“小于”),说明理由:____________。
(4)A、B、C三点代表的平衡状态的平衡常数的大小为:KA____________KB____________KC(填“大于”“等于”或“小于”),并说明理由:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的密闭容器中,采用不同条件进行反应N2(g)+3H2(g)![]() 2NH3(g),根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
2NH3(g),根据下列在相同时间内测定的结果判断,生成氨的速率最快的是
A.v(N2)=0.2mol/(Ls)B.v(NH3)=0.8mol/(Lmin)
C.v(H2)=0.3mol/(Ls)D.v(H2)=1.3mol/(Lmin)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com