
 CuSO4+SO2↑+2H2O,二氧化硫与品红溶液反应生成不稳定的无色物质,故答案为:品红溶液褪色;
CuSO4+SO2↑+2H2O,二氧化硫与品红溶液反应生成不稳定的无色物质,故答案为:品红溶液褪色; ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
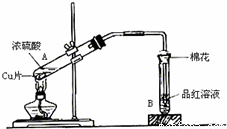
 用如图装置进行铜与一定体积已知浓度的浓硫酸反应的实验研究.
用如图装置进行铜与一定体积已知浓度的浓硫酸反应的实验研究.

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

(1)写出A、B两试管中的实验现象:
A__________________________________、__________________________________(两种即可);B__________________________________。
(2)充分反应后,发现铜和硫酸都有剩余。在不补充浓硫酸的前提下,若使剩余铜片溶解,可再加入物质的化学式为____________________。
(3)测定剩余硫酸的物质的量时,先测铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量。他认为测定SO2的量的方法有多种,下列方案中不可行的是( )
A.将A产生的气体干燥后缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称量
B.将A产生的气体缓缓通入稀硫酸酸化的KMnO4溶液,加足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.将A产生的气体缓缓通入足量用HNO3酸化的Ba(NO3)2溶液,充分反应过滤、洗涤、干燥、称量沉淀
D.用排饱和NaHSO3溶液的方法测出干燥后装置A产生SO2气体的体积(已折算成标准状况)
(4)向反应后的溶液中加入足量的氧化铜,使剩余的硫酸转化为硫酸铜,过滤后将滤液加热浓缩,冷却制得硫酸铜晶体(CuSO4·xH2O),用加热法测定该晶体里结晶水x的值。其中一次实验的数据为:
坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
11.7 | G | 11.7 |
根据数据计算,判断x的实测值比理论值(x=5)_________(填“偏大”或“偏小”),实验中产生误差的原因可能是_________(填字母编号)。
A.硫酸铜晶体中含有不挥发杂质
B.加热失水后露置在空气中冷却
C.加热时有晶体飞溅出去
D.硫酸铜晶体(CuSO4·xH2O)在称量前晶体的表面吸收了水分
查看答案和解析>>
科目:高中化学 来源:2012-2013学年陕西省高三第三次月考化学试卷(解析版) 题型:实验题
(13分) 用如右图装置进行铜与一定体积已知浓度的浓硫酸反应的实验研究。
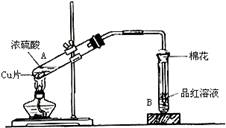
(1)写出试管B中的实验现象 。
(2)写出A处反应的化学方程式,并用双线桥标明电子转移的方向和数目: 。
(3)充分反应后,该学生发现铜和硫酸都有剩余。在不补充浓硫酸的前提下,若要使剩余的铜片溶解,可再加入(要求填写一种不是酸类的物质) 。
(4)B试管口的棉花应沾有的试剂是 ,其作用是 ,离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用如图装置进行铜与一定体积已知浓度的浓硫酸反应的实验研究.
用如图装置进行铜与一定体积已知浓度的浓硫酸反应的实验研究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com